Umwelt- und Lebensstilbedingte Risikofaktoren
Im Rahmen eines Forschungsschwerpunkts, der von der Boehringer Ingelheim Stiftung (BIS) unterstützt wird („Novel and neglected cardiovascular risk factors“), untersucht unser Labor derzeit die Effekte schädlicher Umwelteinflüsse (als „Exposom“ bezeichnet, siehe Abb. 1A) wie Lärm, zukünftig auch Luftverschmutzung (Feinstaub) auf die Gefäßfunktion in Mäusen und entwickelt in diesem Kontext neue Messverfahren, um die Schäden durch diese Umweltrisikofaktoren sichtbar zu machen (Kalinovic&Stamm&Daiber, Free Radic. Biol. Med. 2021; Prof. Daiber, Z/ZB-Projekt im BIS Konsortium, siehe Abb. 1B).
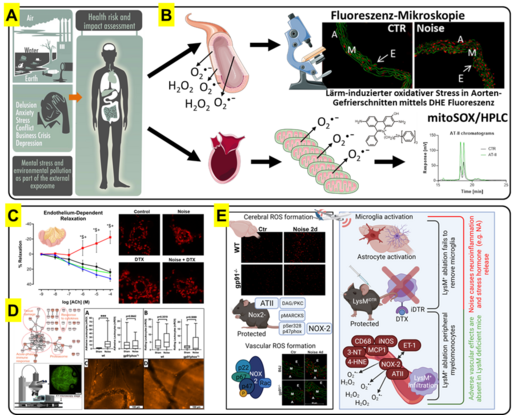
Im Rahmen zweier fundamentaler Veröffentlichungen konnten wir zeigen, dass Fluglärm in Mäusen Stresshormone, Entzündungsreaktionen und oxidativen Stress induziert, was letztendlich zu Gefäßschäden, Gefäßfunktionsstörungen und Bluthochdruck führt (Münzel & Daiber & Kröller-Schön, Eur. Heart J. 2017 und Kröller-Schön & Daiber & Münzel, Eur. Heart J. 2018; Prof. Münzel und Dr. Steven, Projekt 1/1B im BIS Konsortium). Mit diesen Arbeiten konnten wir erstmals oxidative Schäden durch Fluglärm im Gehirn nachweisen und zeigen, dass die Lärmexposition während der Schlafphase deutlich schädlicher ist als die Exposition während der Wachphase. Diese tierexperimentellen Studien lieferten auch die mechanistische Erklärung für die seit langem von der Weltgesundheitsorganisation (WHO) und der europäischen Umweltgesundheitsbehörde (EEA) publizierten Warnungen und epidemiologischen Daten, dass Verkehrslärm krank macht und vor allem das Risiko für eine ischämische Herzkrankheit in der allgemeinen Bevölkerung steigert. Auch die Befunde der in Mainz durchgeführten Humanstudien über die akuten Gesundheitsschäden (veränderte Herz- und Gefäßfunktion) durch eine nächtliche Beschallung mit Fluglärm (Schmidt & Münzel, Eur. Heart J. 2013, Herzog & Schmidt & Münzel, Basic Res. Cardiol. 2019 und Schmidt & Herzog & Münzel, Cardiovasc. Res. 2021) konnten so erklärt werden.
Mit nachfolgenden tierexperimentellen Studien konnten wir nachweisen, dass Fluglärm-induzierte Gefäßschäden durch die Aktivierung des NRF2-abhängigen antioxidativen Schutzsystems vermieden werden konnten, was einen weiteren wichtigen Hinweis auf die zentrale Rolle des oxidativen Stresses lieferte (Bayo Jimenez&Münzel&Daiber, Antioxidants 2021). Fluglärm führte in Mausplasma zu einem entzündlichen Phänotyp, der die von uns beobachteten mikrovaskulären Schäden erklärte (Eckrich&Frenis&Ernst&Daiber, Redox Biol. 2021). Vor allem eine stark erhöhte Bindung der Leukozyten (spezielle Entzündungszellen für die Pathogen-Abwehr) an die Gefäßwand war in den Lärm-exponierten Gefäßen zu beobachten (siehe Abb. 1D). In Mäusen ohne NADPH-Oxidase Typ 2 (genetischer Knockout) war sowohl die Anlagerung von Leukozyten an die Gefäßwand der Mikrozirkulation als auch der entzündliche Phänotyp im Plasma der Mäuse nach Fluglärm abwesend (siehe Abb. 1D). In einer weiteren Studie wurden gezielt die myeloiden Entzündungszellen (z.B. Monozyten und Granulozyten) mittels genetisch-pharmakologischer Behandlung aus den Mäusen entfernt, die dann keine peripheren Gefäßschäden mehr zeigten (Frenis & Münzel & Steven, Basic Res. Cardiol. 2021). Erstaunlicherweise war die durch Fluglärm vermittelte Stressreaktion (Corticosteron und Katecholamine) sowie die Neuroinflammation nach Entfernung der myeloiden Entzündungszellen immer noch vorhanden, was auf eine klare Trennung zwischen Lärmeffekten im Gehirn und der Peripherie schließen lässt (zusammengefasst in Frenis & Daiber, Front. Mol. Biosci. 2021).
Daneben wurden die Mechanismen der Gefäßschäden durch Fluglärm in Mäusen mit Bluthochdruck untersucht (Dr. Sebastian Steven, Projekt der Fresenius Stiftung). Dabei zeigte sich, dass die Lärm-Exposition bei bereits bestehendem Bluthochdruck die Gefäß- und Hirnschäden weiter steigert und den oxidativen Stress sowie Entzündungsreaktionen additiv erhöht (Steven & Frenis & Münzel, Redox Biol. 2020). Derzeit werden auch die additiven Effekte von Lärm und Diabetes (Dr. Kvandova und Dr. Jansen, Projekt N2 im BIS Konsortium) sowie von Lärm und Myokardinfarkt untersucht (Dr. Molitor und Prof. Wenzel, Projekt N1 im BIS Konsortium). Auch wird die Rolle der AMP-abhängigen Proteinkinase (AMPK) bei der nicht-medikamentösen Therapie von Herz-Kreislauf-Erkrankungen durch körperliches Training (exercise) bzw. zeitlich begrenztes Fasten (caloric restriction) im Hinblick auf Lärm-induzierte Gefäßschäden untersucht (Dr. Swenja Kröller-Schön & Dr. Thomas Jansen, DFG-Projekt). Alle Befunde unserer langjährigen Lärmforschung konnten wir im Rahmen zweier hochkarätig publizierter Übersichtsarbeiten zusammenfassen (Münzel & Daiber & Sorensen, Annu. Rev. Public Health 2020 und Münzel&Sorensen&Daiber, Nat. Rev. Cardiol. 2021).
Im Rahmen eines Forschungsschwerpunkts, der von der Boehringer Ingelheim Stiftung (BIS) unterstützt wird („Novel and neglected cardiovascular risk factors“), untersucht unser Labor derzeit die Effekte schädlicher Umwelteinflüsse (als „Exposom“ bezeichnet, siehe Abb. 1A) wie Lärm, zukünftig auch Luftverschmutzung (Feinstaub) auf die Gefäßfunktion in Mäusen und entwickelt in diesem Kontext neue Messverfahren, um die Schäden durch diese Umweltrisikofaktoren sichtbar zu machen (Kalinovic&Stamm&Daiber, Free Radic. Biol. Med. 2021; Prof. Daiber, Z/ZB-Projekt im BIS Konsortium, siehe Abb. 1B).
Im Rahmen zweier fundamentaler Veröffentlichungen konnten wir zeigen, dass Fluglärm in Mäusen Stresshormone, Entzündungsreaktionen und oxidativen Stress induziert, was letztendlich zu Gefäßschäden, Gefäßfunktionsstörungen und Bluthochdruck führt (Münzel & Daiber & Kröller-Schön, Eur. Heart J. 2017 und Kröller-Schön & Daiber & Münzel, Eur. Heart J. 2018; Prof. Münzel und Dr. Steven, Projekt 1/1B im BIS Konsortium). Mit diesen Arbeiten konnten wir erstmals oxidative Schäden durch Fluglärm im Gehirn nachweisen und zeigen, dass die Lärmexposition während der Schlafphase deutlich schädlicher ist als die Exposition während der Wachphase. Diese tierexperimentellen Studien lieferten auch die mechanistische Erklärung für die seit langem von der Weltgesundheitsorganisation (WHO) und der europäischen Umweltgesundheitsbehörde (EEA) publizierten Warnungen und epidemiologischen Daten, dass Verkehrslärm krank macht und vor allem das Risiko für eine ischämische Herzkrankheit in der allgemeinen Bevölkerung steigert. Auch die Befunde der in Mainz durchgeführten Humanstudien über die akuten Gesundheitsschäden (veränderte Herz- und Gefäßfunktion) durch eine nächtliche Beschallung mit Fluglärm (Schmidt & Münzel, Eur. Heart J. 2013, Herzog & Schmidt & Münzel, Basic Res. Cardiol. 2019 und Schmidt & Herzog & Münzel, Cardiovasc. Res. 2021) konnten so erklärt werden.
Mit nachfolgenden tierexperimentellen Studien konnten wir nachweisen, dass Fluglärm-induzierte Gefäßschäden durch die Aktivierung des NRF2-abhängigen antioxidativen Schutzsystems vermieden werden konnten, was einen weiteren wichtigen Hinweis auf die zentrale Rolle des oxidativen Stresses lieferte (Bayo Jimenez&Münzel&Daiber, Antioxidants 2021). Fluglärm führte in Mausplasma zu einem entzündlichen Phänotyp, der die von uns beobachteten mikrovaskulären Schäden erklärte (Eckrich&Frenis&Ernst&Daiber, Redox Biol. 2021). Vor allem eine stark erhöhte Bindung der Leukozyten (spezielle Entzündungszellen für die Pathogen-Abwehr) an die Gefäßwand war in den Lärm-exponierten Gefäßen zu beobachten (siehe Abb. 1D). In Mäusen ohne NADPH-Oxidase Typ 2 (genetischer Knockout) war sowohl die Anlagerung von Leukozyten an die Gefäßwand der Mikrozirkulation als auch der entzündliche Phänotyp im Plasma der Mäuse nach Fluglärm abwesend (siehe Abb. 1D). In einer weiteren Studie wurden gezielt die myeloiden Entzündungszellen (z.B. Monozyten und Granulozyten) mittels genetisch-pharmakologischer Behandlung aus den Mäusen entfernt, die dann keine peripheren Gefäßschäden mehr zeigten (Frenis & Münzel & Steven, Basic Res. Cardiol. 2021). Erstaunlicherweise war die durch Fluglärm vermittelte Stressreaktion (Corticosteron und Katecholamine) sowie die Neuroinflammation nach Entfernung der myeloiden Entzündungszellen immer noch vorhanden, was auf eine klare Trennung zwischen Lärmeffekten im Gehirn und der Peripherie schließen lässt (zusammengefasst in Frenis & Daiber, Front. Mol. Biosci. 2021).
Daneben wurden die Mechanismen der Gefäßschäden durch Fluglärm in Mäusen mit Bluthochdruck untersucht (Dr. Sebastian Steven, Projekt der Fresenius Stiftung). Dabei zeigte sich, dass die Lärm-Exposition bei bereits bestehendem Bluthochdruck die Gefäß- und Hirnschäden weiter steigert und den oxidativen Stress sowie Entzündungsreaktionen additiv erhöht (Steven & Frenis & Münzel, Redox Biol. 2020). Derzeit werden auch die additiven Effekte von Lärm und Diabetes (Dr. Kvandova und Dr. Jansen, Projekt N2 im BIS Konsortium) sowie von Lärm und Myokardinfarkt untersucht (Dr. Molitor und Prof. Wenzel, Projekt N1 im BIS Konsortium). Auch wird die Rolle der AMP-abhängigen Proteinkinase (AMPK) bei der nicht-medikamentösen Therapie von Herz-Kreislauf-Erkrankungen durch körperliches Training (exercise) bzw. zeitlich begrenztes Fasten (caloric restriction) im Hinblick auf Lärm-induzierte Gefäßschäden untersucht (Dr. Swenja Kröller-Schön & Dr. Thomas Jansen, DFG-Projekt). Alle Befunde unserer langjährigen Lärmforschung konnten wir im Rahmen zweier hochkarätig publizierter Übersichtsarbeiten zusammenfassen (Münzel & Daiber & Sorensen, Annu. Rev. Public Health 2020 und Münzel&Sorensen&Daiber, Nat. Rev. Cardiol. 2021).
Studien zu inhalativen Umweltrisikofaktoren wie Feinstaub und E-Zigarettendampf bzw. Shisha-Rauch
Rauchen und "Dampfen", egal ob mittels Tabakzigarette, E-Zigarette und Wasserpfeife, erhöht die Steifigkeit der Arterien, verursacht Entzündungsreaktionen sowie DNA-Schäden und führt so zu einer Vielzahl von Gesundheitsproblemen, wie eine Übersichtsarbeit aus unserem Labor darlegt (Münzel&Daiber, Eur. Heart J. 2020). Diese Studie ist weltweit einzigartig, indem sie die drei unterschiedlichen Formen des Rauchens oder „Dampfens“ hinsichtlich der negativen Effekte auf die Gesundheit des Menschen und die Funktion der Endothelzellschicht (kleidet die Innenwand der Blutgefäße aus) vergleicht. Dabei wurden auch die toxischen Stoffe und Pathomechanismen verglichen (Abb. 2A,B), die den Gesundheitsschäden durch Tabakzigarette, E-Zigarette und Wasserpfeife zugrunde liegen. Der Hauptbefund dieser Studie ist, dass sowohl der Konsum von Tabakzigaretten, E-Zigaretten als auch Wasserpfeifen das Risiko für kardiovaskuläre Krankheiten und die Steifigkeit der Arterien erhöhen (Abb. 2C). Auch die Endothelfunktion (Weitstellung der Gefäße) wird durch alle drei Formen des Rauchens oder "Dampfens" stark eingeschränkt und weist damit auf das Frühstadium der Atherosklerose hin.
Rauchen und "Dampfen", egal ob mittels Tabakzigarette, E-Zigarette und Wasserpfeife, erhöht die Steifigkeit der Arterien, verursacht Entzündungsreaktionen sowie DNA-Schäden und führt so zu einer Vielzahl von Gesundheitsproblemen, wie eine Übersichtsarbeit aus unserem Labor darlegt (Münzel&Daiber, Eur. Heart J. 2020). Diese Studie ist weltweit einzigartig, indem sie die drei unterschiedlichen Formen des Rauchens oder „Dampfens“ hinsichtlich der negativen Effekte auf die Gesundheit des Menschen und die Funktion der Endothelzellschicht (kleidet die Innenwand der Blutgefäße aus) vergleicht. Dabei wurden auch die toxischen Stoffe und Pathomechanismen verglichen (Abb. 2A,B), die den Gesundheitsschäden durch Tabakzigarette, E-Zigarette und Wasserpfeife zugrunde liegen. Der Hauptbefund dieser Studie ist, dass sowohl der Konsum von Tabakzigaretten, E-Zigaretten als auch Wasserpfeifen das Risiko für kardiovaskuläre Krankheiten und die Steifigkeit der Arterien erhöhen (Abb. 2C). Auch die Endothelfunktion (Weitstellung der Gefäße) wird durch alle drei Formen des Rauchens oder "Dampfens" stark eingeschränkt und weist damit auf das Frühstadium der Atherosklerose hin.

Um das Gesundheitsrisiko inhalativer Schadstoffe besser zu charakterisieren, hat unsere Arbeitsgruppe in den vergangenen Jahren Expositionssysteme für E-Zigarettendampf, Shisha Rauch und Feinstaub etabliert (Abb. 3 A,C,D). Eine umfangreiche Studie zu den gesundheitsschädlichen Wirkungen und zugrunde liegenden Pathomechanismen von E-Zigarettendampf wurde bereits im Mausmodell durchgeführt (Kuntic&Daiber&Münzel, Eur. Heart J. 2020). Als wesentliche Befunde konnte unsere Arbeitsgruppe in Kooperation mit Prof. Hoffmann (analytische Chemie der Johannes Gutenberg-Universität) toxische Aldehyde wie Formaldehyd, Acetaldehyd oder Acrolein im Dampfkondensat nachweisen, die die beobachteten Schäden in der Lunge, im Gehirn und im Gefäßsystem auf mechanistischer Ebene erklären (Abb. 3B). Als maßgebliche Pathomechanismen wurden Entzündungsreaktionen und vor allem oxidativer Stress identifiziert. Die reaktiven Aldehyde aktivieren Immunzellen und deren enzymatisches System zur Bildung reaktiver Sauerstoffspezies (freie Radikale). Dies führt zu oxidativen Schäden bzw. verringerter Expression wichtiger Schutzenzyme wie der endothelialen und neuronalen Stickstoffmonoxidsynthase sowie dem Foxo3 Transkriptionsfaktor. Nachfolgend kommt es zur Schädigung der Gefäßfunktion und Bluthochdruck, was wir auch in gesunden Probanden nach E-Zigarettenkonsum feststellen konnten.
scheffel@uni-mainz.de

Derzeit laufen auch umfangreiche Studien, um die gefäßschädigende Wirkung von Feinstaub auf molekularer Ebene zu charakterisieren. Dafür wurde ein komplexes Expositionssystem für Feinstaub etabliert mit dem Alleinstellungsmerkmal, dass damit auch kombinierte Expositionen mit Feinstaub und Lärm durchgeführt werden können (Abb. 3C). Erste Befunde zu den gesundheitsschädlichen Wirkungen von Feinstaub in Kombination mit Lärm im Mausmodell sollen im Laufe des Jahres 2022 publiziert werden. Analog zu den mechanistischen Studien über die kardiovaskulären Schäden von E-Zigarettendampf (Kuntic&Daiber&Münzel, Eur. Heart J. 2020) laufen aktuell erste Pilotstudien zur Charakterisierung der Schäden in der Lunge, im Gehirn und im Gefäßsystem durch Shisha Rauch (Abb. 3D). Hier sollen verschiedene Tabaksorten (mit und ohne Geschmacksstoffe) sowie verschiedene Mengen Kohle für die Verbrennung des Tabaks untersucht werden.
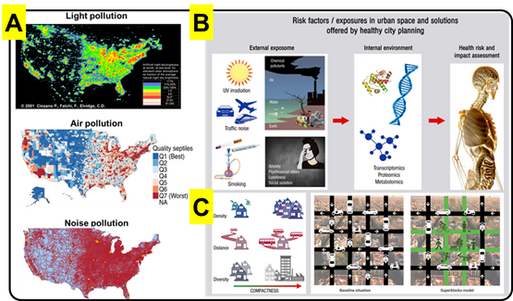
Umweltforschung wird generell zunehmend wichtiger, wie von unserer Arbeitsgruppe im Rahmen einer Übersichtsarbeit eindrucksvoll dargelegt (Münzel&Daiber&Rajagopalan, Eur. Heart J. 2021). Vor allem in Ballungsräumen und Großstädten hat das Zusammenwirken verschiedener Umweltrisikofaktoren wie Lichtverschmutzung bei Nacht, Luftverschmutzung und Verkehrslärm dramatische Auswirkungen auf die Gesundheit der Bevölkerung und zeigt eine besorgniserregende Co-Lokalisation (Abb. 4A). Nach dem „Exposom“-Konzept verursachen Umweltstressoren wie Verkehrslärm, Luft-/Wasser-/Bodenverschmutzung Schäden und krankheitsfördernde Veränderungen auf molekularer Ebene in unseren Organen (z.B. Erbgut, Proteine und andere Biomoleküle/Metaboliten), die dann zu einem messbaren Anstieg von chronischen Erkrankungen und Todesfällen führen (Abb. 4B). Dem kann und muss unter anderem durch ein „gesundes Städte Design“ entgegengewirkt werden (z.B. kompakte Städte, d.h. kurze Wege von der Wohnung zur Arbeit, Einkaufsmöglichkeiten oder Kulturellen Angeboten; autofreie Zonen), wie es die moderne Städteplanung empfiehlt (Abb. 4C). Das Fazit unsere Übersichtsarbeit ist die Erkenntnis, dass unser Erbgut zwar die Anfälligkeit für Gesundheitsrisikofaktoren definiert, aber unsere Umwelt und unser Lebensstil letztendlich den Ausschlag geben, ob wir chronische Erkrankungen entwickeln oder nicht. Dies wird mit dem englischen Ausdruck „genetics loads the gun but the environment pulls the trigger“ sehr treffend umschrieben.