AG Experimentelle Herzinsuffizienz-Forschung
Kurzbeschreibung der Arbeitsgruppe
Herzinsuffizienz zählt weltweit zu den häufigsten chronischen Erkrankungen und stellt eine führende Ursache für Hospitalisierung und Mortalität dar. Die Arbeitsgruppe „Experimentelle Herzinsuffizienzforschung“ untersucht zentrale pathophysiologische Prozesse, die zur Entstehung und Progression sowohl der ischämischen Herzinsuffizienz – etwa infolge eines Myokardinfarkts – als auch der nicht-ischämischen Herzinsuffizienz, wie der Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF), beitragen.
Ein besonderer Schwerpunkt liegt auf fehlgeleiteten Immunantworten und ihrer Interaktion mit dem Gerinnungssystem, die nach einem Infarkt eine überschießende Entzündung, fibrotischen Umbau und den langfristigen Funktionsverlust des Herzens fördern können.
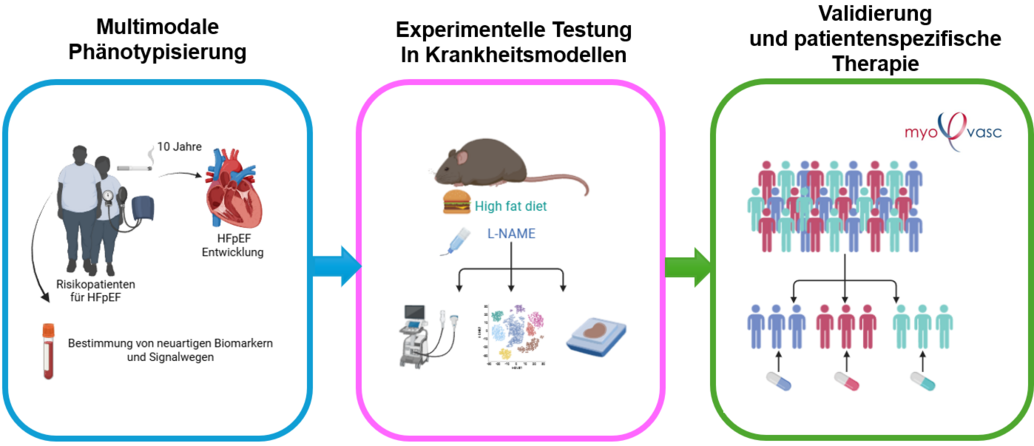
Die Arbeitsgruppe verfolgt einen stark translationalen Forschungsansatz: Ausgangspunkt ist die tiefgreifende klinische Charakterisierung von Patienten an der Universitätsmedizin Mainz, gefolgt von funktionellen und. Mechanistischen Untersuchungen murinen Krankheitsmodellen, um krankheitsrelevante Signalwege zu identifizieren. Die Relevanz neuer molekularer Zielstrukturen wird anschließend in großen klinischen Kohorten, wie der MyoVasc-Studie, validiert. Ziel ist es, innovative Biomarker und gezielte Therapien zu entwickeln, die eine frühzeitige Diagnostik und personalisierte Behandlung von Herzinsuffizienz ermöglichen.
Forschungsschwerpunkte
·Immunologisch-thrombotische Signalwege bei ischämischer Herzinsuffizienz
·Mechanismen der Immunzellmodifikation im kardialen Remodelling
·Zelluläre Mechanismen und die Rolle von systemischer Inflammation bei HFpEF
·Interorgankommunikation und systemische Effekte der Herzinsuffizienz
Translationale Zielsetzung
Kooperationspartner
•Prof. Hendrik Sager (Deutsches Herzzentrum TU München)
•Prof. Christian Schulz (Mannheim Institute for innate immunoscience)
•PD Leo Nicolai, PD Rainer Kaiser (LMU München)
•Prof. Jonny Kim, PD Boris Strilic (TRON gGmbH)
•Prof. Stefanie Dimmeler, Dr. Simone Glaser (Institute of Cardiovascular Regeneration Frankfurt)
Funding

Aktuelles
Mitglieder der Arbeitsgruppe
Publikationen
1. Molitor M*, Rudi WS*, Garlapati VS, Finger S, Schüler R, Kossmann S, Lagrange J, Nguyen TS, Wild J, Knopp T, Karbach SH, Knorr M, Ruf W, Münzel T, Wenzel P. Nox2+ Myeloid cells drive vascular inflammation and endothelial dysfunction in heart failure after myocardial infarction via angiotensin II receptor type 1. Cardiovasc Res. 2021 Jan 1;117(1):162-177.doi: 10.1093/cvr/cvaa042.
2. Efentakis P*, Molitor M*, Kossmann S, Bochenek ML, Wild J, Lagrange J, Finger S, Jung R, Karbach S, Schäfer K, Schulz A, Wild P, Münzel T, Wenzel P. Tubulin-folding cofactor E deficiency promotes vascular dysfunction by increased endoplasmic reticulum stress. Eur Heart J. 2021 Jun 16:ehab222. doi: 10.1093/eurheartj/ehab222.
3. Molitor M*, Jimenez MTB*, Hahad O, Witzler C, Finger S, Garlapati VS, Rajlic S, Knopp T, Bieler T, Aluia M, Wild J, Lagrange J, Blessing R, Rapp S, Schulz A, Kleinert H, Karbach S, Steven S, Ruf W, Wild P, Daiber A, Münzel T, Wenzel P. Aircraft noise exposure induces proinflammatory vascular conditioning and amplifies vascular dysfunction and impairment
of cardiac function after myocardial infarction. Cardiovasc Res. 2023 Jan 26:cvad021. doi: 10.1093/cvr/cvad021. Epub ahead of print. PMID: 36702626.
4. Brandt M, Dörschmann H, Khraisat S, Knopp T, Ringen J, Kalinovic S, Garlapati V, Siemer S, Molitor M, Göbel S, Stauber R, Karbach SH, Münzel T, Daiber A, Wenzel P. Telomere Shortening in Hypertensive Heart Disease Depends on Oxidative DNA Damage and Predicts Impaired Recovery of Cardiac Function in Heart Failure. Hypertension. 2022 Oct;79(10):2173-2184. doi: 10.1161/HYPERTENSIONAHA.121.18935. Epub 2022 Jul 18. PMID: 35862118.
5. Garlapati V, Molitor M, Michna T, Harms GS, Finger S, Jung R, Lagrange J, Efentakis P, Wild J, Knorr M, Karbach S, Wild S, Vujacic-Mirski K, Münzel T, Daiber A, Brandt M, Gori T, Milting H, Tenzer S, Ruf W*, Wenzel P*. Targeting myeloid cell coagulation signaling blocks MAP kinase/TGF-β1-driven fibrotic remodeling in ischemic heart failure. J Clin Invest. 2023 Feb 15;133(4):e156436. doi: 10.1172/JCI156436. PMID: 36548062; PMCID: PMC9927945
6. Garlapati V, Luo Q, Posma J, Aluia M, Nguyen TS, Grunz K, Molitor M, Finger S, Harms G, Bopp T, Ruf W*, Wenzel P*. Macrophage-Expressed Coagulation Factor VII Promotes Adverse Cardiac Remodeling. Circ Res. 2024 Sep 27;135(8):841-855. doi: 10.1161/CIRCRESAHA.123.324114. Epub 2024 Sep 5. PMID: 39234697