Forschungsschwerpunkt AG Sommer
Forschungsschwerpunkte
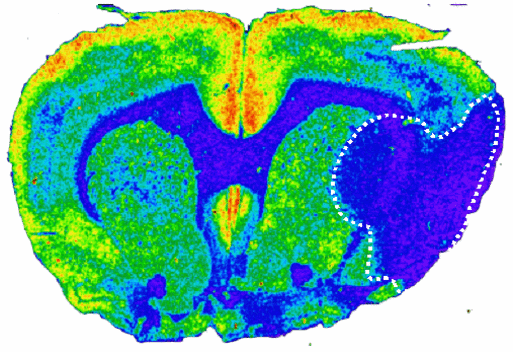
Ein wesentlicher thematischer Schwerpunkt liegt auf der zerebralen Ischämie-Forschung. Unser Forschungsinteresse fokussiert hierbei auf die molekularen Mechanismen der Neuroprotektion nach globaler und fokaler Ischämie.Schwerpunkt globale Ischämie
Nach einem transienten zerebralen Durchblutungsstop (z. B. Herz-Kreislauf-Stillstand mit anschließender Reanimation) gehen nicht alle Nervenzellen, sondern nur spezifische Subpopulationen nach einigen Tagen zugrunde. Obwohl dieses Phänomen seit über 100 Jahren bekannt ist, sind die molekularen Grundlagen dieses verzögerten neuronalen Zelltodes bisher nicht geklärt. Im Tierexperiment ließ sich außerdem zeigen, dass durch eine kurze Ischämie-Periode eine endogene Protektion gegenüber einer nachfolgenden Ischämie in vulnerablen Nervenzellen induziert werden kann. Auch die biologischen Grundlagen dieses Phänomens sind unklar.Neben Änderungen der Genexpression spielen offensichtlich auch Modifikationen in der Expression und Funktion verschiedener ionotroper und metabotropischer Glutamat-Rezeptoren eine wichtige Rolle. Hierbei fanden sich Hinweise, dass die endogene Toleranz-Induktion mit einer Verschiebung des Gleichgewichts zwischen neuronaler Erregung und Hemmung zugunsten der Inhibition assoziiert ist.
In aktuellen Projekten untersuchen wir die molekularen Grundlagen dieses Phänomens.
Kooperationspartner:
- Prof. Dr. J. Kirsch, Institut für Anatomie und Zellbiologie, Universität Heidelberg
MAIFOR
Schwerpunkt Hirninfarkt („Schlaganfall")
Der Hirninfarkt ist definiert als Nekrose eines Hirnareals aufgrund eines Gefäßverschlusses. Während das Zentrum des Infarktes („ischemic core") irreversibel geschädigt ist, weisen die Nervenzellen im Randbereich des Infarktes mit weniger stark reduzierter Durchblutung und partiell erhaltenem Energiestoffwechsel zunächst nur eine Funktionsstörung bei noch erhaltener struktureller Integrität auf. Dieses Gebiet, das auch als „Penumbra" bezeichnet wird, steht potentiell einer therapeutischen Intervention offen.In verschiedenen Kooperationen werden Zelltod-vermittelnde und neuroprotektive Pathways analysiert. Ein weiterer Schwerpunkt liegt auf der Analyse regenerativer postischämischer Prozesse sowie deren therapeutischer Optimierung
Kooperationspartner:
- Prof. Dr. J. Kirsch, Institut für Anatomie und Zellbiologie, Lehrstuhl II, Medizinische Zellbiologie, Universität Heidelberg
- Prof. Dr. W.-R. Schäbitz, Evangelisches Krankenhaus Bielefeld
- Prof. Dr. R. Veltkamp, Neurologische Universitätsklinik Heidelberg (aktuell Imperial College London)
DFG
Schwerpunkt Antiphospholipid Syndrom
Das Antiphospholipid Syndrom (APS) ist eine Autoimmunerkrankung, die durch die Anwesenheit von anti-Phospholipid Antikörpern und durch das Auftreten von venösen und / oder arteriellen Thrombosen charakterisiert ist. Das APS kann nahezu jedes Organ oder Organsystem betreffen. Im Bereich des ZNS kann es durch Thromben und Emboli zu rezidivierenden transitorisch ischämischen Attacken (TIAs) und zu Schlaganfällen kommen. Nicht-ischämische ZNS-Symptome sind zwar immer wieder beschrieben, sind aber aktuell nicht als Diagnosekriterium anerkannt. Aus tierexperimentellen Studien ist jedoch gesichert, dass es auch in Abwesenheit ischämischer Läsionen zu neurologischen Auffälligkeiten kommt. In unserer Arbeitsgruppe konnte wir in Kooperation mit der Arbeitsgruppe von Prof. Chapman (Tel Aviv, Israel) zeigen, dass es beim experimentellen APS in Mäusen zu tiefgreifenden Veränderungen in verschiedenen Neurotransmitterrezeptor-Systemen wie auch zu strukturellen Veränderungen hippokampaler Nervenzellen kommt, die die bei diesen Tieren beobachteten Verhaltensauffälligkeiten erklären können. In aktuellen und geplanten Projekten soll zum einen der zeitliche Verlauf der Erkrankung detailliert auf molekularer Ebene charakterisiert werden, zum anderen sollen Zielstrukturen der Antiphospholipid-Antikörper identifiziert werden.Kooperationspartner
- Prof. Dr. J. Chapman, Associate Professor and Chairman of Neurology Sheba Medical Center Head of Department of Neurology Sackler Faculty of Medicine Tel Aviv University
MAIFOR