Die Inzidenz einer aneurysmatischen Subarachnoidalblutung (SAB) beträgt in Mitteleuropa 6 pro 100.000 Personenjahre. Die SAB weist eine 30-Tages-Letalität von 45-50% auf. Als problematisch gelten vor allem die zwischen dem 4. und 14. Tag nach einer SAB in bis zu 30% der Fälle auftretenden Vasospasmen (Gefäßverengungen) der Hirnbasisarterien mit konsekutiver Perfusionsminderung und resultierender zerebraler Minderperfusion. In Folge der Hirninfarkte versterben die Patienten oder erleiden schwere Behinderungen. Die Optionen zur Therapie der vasospasmusinduzierten Ischämie sind bisher unzureichend.
Aufgrund der bislang insuffizienten therapeutischen Optionen der SAB-assoziierten Vasospasmen, als auch mit Blick auf die Erforschung weiterer neuartiger Medikamente, nimmt der Bedarf an experimentellen Studien an einem optimierten Tiermodell zu.
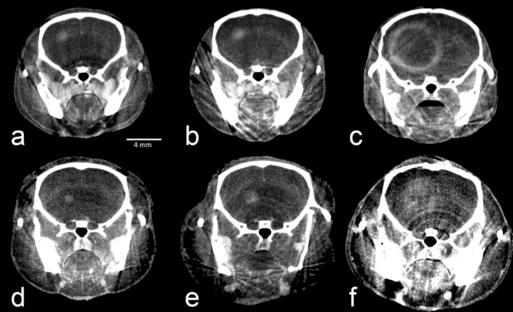
Unser besonderer Schwerpunkte liegt daher auf der in vivo Darstellung und Analyse der Hirngefäße der Maus mittels Mikro-CT und digitaler Subtraktionsangiographie (DSA) sowie CT-Angiographie (CTA). So haben wir als erste AG weltweit die hochauflösende Darstellung der Hirnbasisarterien der Maus in vivo durchgeführt und publiziert [1-4]. Aktuell beschäftigen wir uns mit der longitudinalen in vivo Darstellung zerebraler Vasospasmen nach Induktion einer SAB im Maus-Modell mittels DSA. Dieses Pilotprojekt stellt die Grundlage für die Entwicklung und Testung neuartiger spasmolytischer und/oder neuroprotektiver Substanzen, um SAB-induzierte zerebrale Vasospasmen zukünftig effektiver behandeln zu können.Durch Kooperationen mit verschiedenen Forschungsgruppen, insbesondere im Bereich der Bildgebung, hat sich die AG darüber hinaus mit der CT- und MRT- Bildgebung weiterer Organe und Pathologien der Maus befasst. Dazu gehören beispielsweise Gehirntumore (
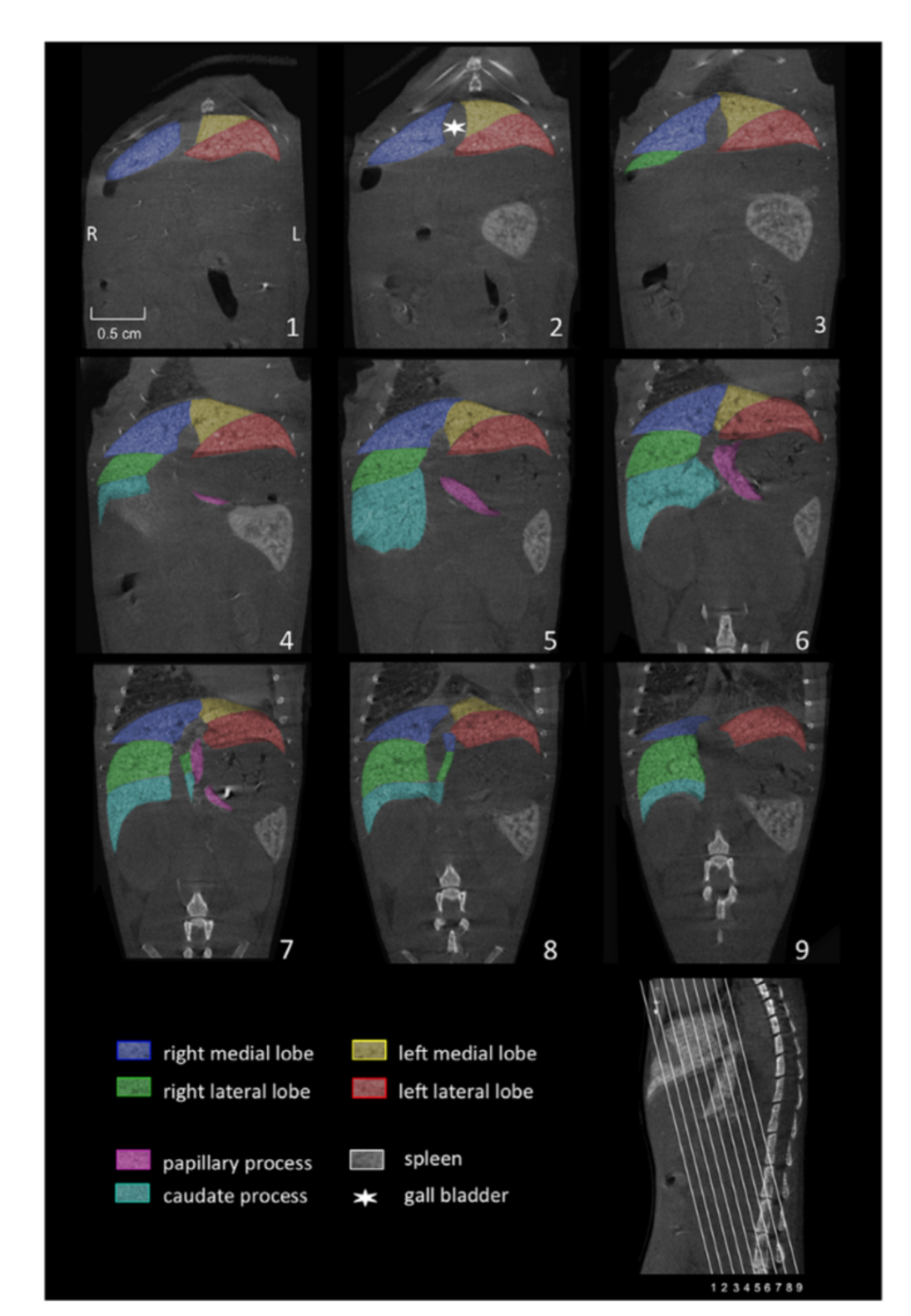
Abb. 3), Colonpolypen, Leberanatomie (
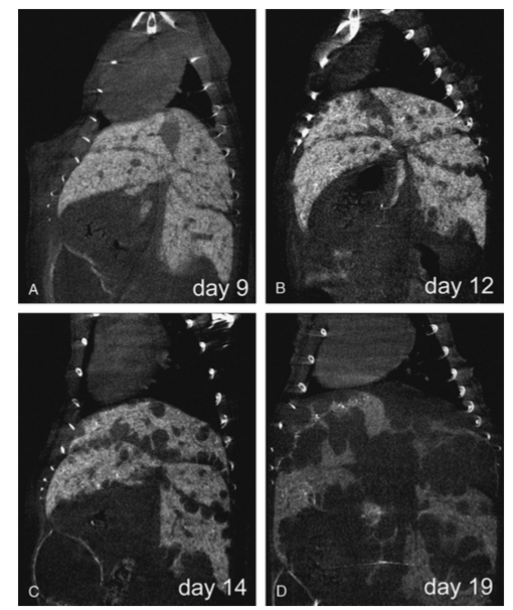
Abb. 4) , Lebermetastasen (
Abb. 5) oder Melanome. Im Rahmen der Darstellung thorakaler und abdomineller Organe wurden Methoden für die Single-breath-stop CT-Bildgebung in der Maus optimiert.
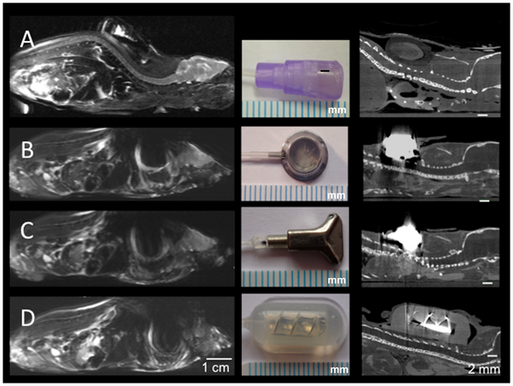
Für die wiederholte Injektion von Kontratsmitteln oder Medikamenten hat die AG ferner einen MRT artefaktfreien Mini-Port für die Maus entwickelt (Abb. 6) und mehrere Übersichtsarbeiten zur Mikro-CT basierten Kleintierbildgebung publiziert.