Forschung im Institut für Translationale Immunologie
Die häufig interdisziplinär geförderten Projekte sind z.T. eng mit anderen Instituten und Kliniken in Mainz, Deutschland oder international verzahnt. Beispiele sind die DFG-Sonderforschungsbereiche SFB1066, SFB1292, SFB-TR128, DFG Einzelprojekte, EU-Projekte (EPOS, LITMUS), Projekte der deutschen Krebshilfe, des BMBF und zahlreiche, meist translationale Forschungsinitiativen mit dem Ziel neuer Projektbeantragungen.Das TIM ist international besetzt und bietet breite Qualifikationsmöglichkeiten im Bereich der translationalen Forschung, von der Masterarbeit bis zur Promotion und Post-Doc-Qualifikation. Das TIM finanziert sich nahezu ausschliesslich über kompetitiv eingeworbene Drittmittelprojekte und leistungsorientierte Mittelzuweisungen (LOM) der Universitätsmedizin.
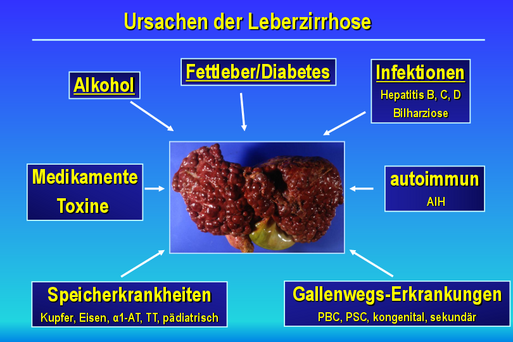
1. Chronischer Lebererkrankungen, Leberfibrose und Leberkrebs
- Untersuchung der zellulären und molekularen Mechanismen überschüssiger Bindegewebsablagerungen (Fibrogenese) bei der Leberfibrose und Zirrhose und ihrer Auflösung (Fibrolyse)
- Entwicklung und Validierung nicht-invasiver Methoden zur Messung der Fibrose, Fibroseprogression und Fibroseregression bei Patienten mit Leberfibrose (Lungenfibrose), insbesondere neue Fibrosemarker (Protein- und Mikropartikel-Biomarker) im Serum oder Plasma sowie quantitative molekulare Bildgebung der Fibrose und Fibrogenese
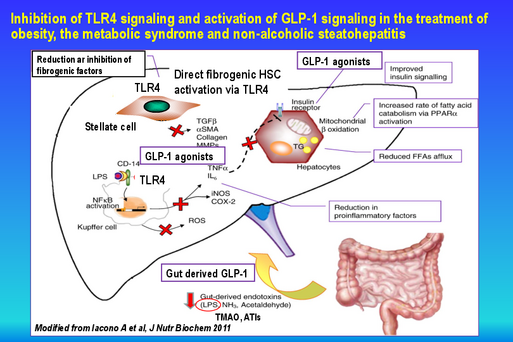
- Entwicklung und Validierung neuer Therapien der nichtalkoholischen Steatohepatitis (NASH)
- Entwicklung und Validierung antifibrotischer Therapien, die die Fibroseprogression hemmen oder eine Fibroseregression induzieren: „small molecules“, small interfering RNA (siRNA), Antisense-Oligonukleotide (ASOs), nanopartikuläre Trägersysteme
- Einsatz von Zellkulturen, Gewebekulturen und tierexperimentellen Modellen der Leberfibrose, und der Leberentzündung
- Entwicklung neuer transgener Mausmodelle mit Relevanz für die Leberfibrose.
- Planung und Durchführung klinischer Phase 1-2 Studien zur Therapie der Leberfibrose und von Leberkrebs
- Zusammenarbeit u.a. mit Labors, Biotech-Firmen und Kliniken in Deutschland, Europa und den USA; in Mainz (JGU) Projekte mit Arbeitsgruppen des FZI, des CTH, der Kardiologie, Pharmakologie, Chemie, Nanochemie und Polymerchemie.
- Untersuchungen zum primären Leberzell-, Lungen-, Colon- und Pankreaskarzinom sowie Metastasen; Einsatz von Zellkulturen, Gewebekulturen und tierexperimentellen Modellen
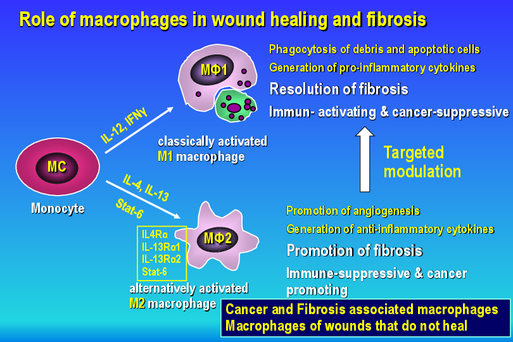
- Rolle der tumorassoziierten Makrophagen, anderer Immunzellen und der Tumor-Myofibroblasten (Tumor Micro-Environment) bei der Progression und Regression dieser Tumorerkrankungen
- Gezielte therapeutische Beeinflussung dieser Zellen und anderer Zellen des Tumor-Mikromilieus („small molecules“, siRNA, ASO, nanopartikuläre Trägersysteme)
- Entwicklung und Validierung innovativer CAR T-Zelltherapien
- Entwicklung und Validierung innovativer Kombinationstherapien zur besseren Krebstherapie
- Entwicklung und Validierung neuer Serum/Plasma-Biomarker der Tumorprogression und -regression
- Planung und Durchführung klinischer Phase 1-2 Studien zur Tumortherapie (in Zusammenarbeit mit der Hämato-Onkologie der UM)
- Untersuchung molekularer Mechanismen chronisch entzündlicher Darmerkrankungen (CED) in verschiedenen Mausmodelle
- Testung neuer pharmakologischer, immunologischer und probiotischer Therapien der CED
- Entwicklung neuer serologischer Marker der CED
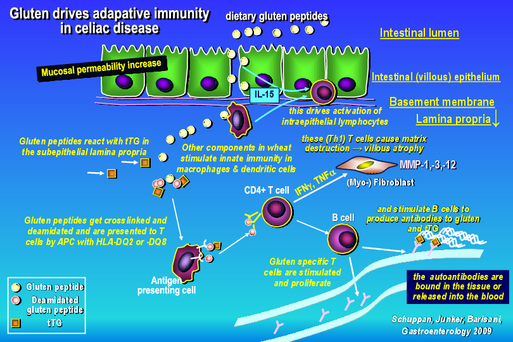
- Untersuchung molekularer Mechanismen der Zöliakie in human transgenen und immunologisch humanisierten Mausmodellen
- Testung neuer pharmakologischer, immunologischer und probiotischer Therapien der Zöliakie im transgenen Mausmodell
- Durchführung von Phase 1-3 klinischen Studien, u.a. mit neuen Medikamenten, zur Behandlung der Zöliakie und refraktären Zöliakie
- Entwicklung neuer diagnostischer u.a. serologischer Marker der Zöliakie
- Zelluläre und in vivo Untersuchungen zur ATI-Sensitivität (Modelle für Autoimmunkrankheiten, Fibrose und Karzinomentwicklung)
- Zelluläre und in vivo Untersuchungen zu (atypischen) Nahrungsmittelallergien („Reizdarmsyndrom“)
- Klinische Studien zur ATI-Sensitivität bei Autoimmunerkrankungen und Allergien
- Molekulare Untersuchungen zu ATIs und Allergenen in alten und neuen Weizensorten und prozessierten Nahrungsmitteln
- Generierung und Testung ATI-reduzierter transgener Weizen
- Effekt definierter Mikrobiota und Probiotika, Nahrungskomponenten und ihrer mikrobiellen Metabolite auf intestinale und extraintestinale Entzündungen, die nicht-alkoholische Steatohepatitis (NASH) und das metabolische Syndrom
- Immunologische Mechanismen klassischer und atypischer (IgE-negativer) Allergien, insbesondere gegen häufige Nahrungsmittel (Weizen, Milch, Soja, Hefen); die Rolle intestinaler Signale bei inhalativen Allergien
- Pathologie und Mechanismen schwerer Multisystem-Infektionen (COVID-19); Entwicklung und klinische Validierung von serologischen Biomarkern für COVID-19 und insbesondere Long-COVID und das chronische Erschöpfungssyndrom (CFS)
- Entwicklung quantitativer molekularer Bildgebung von Organfibrosen, insbesondere der Leberfibrose und –fibrogenese
- Molekulare Pathobiochemie der extrazellulären Matrix
- Entwicklung und Validierung von Trägersystemen für den Organ- und Zell-spezifischen Transport von siRNA, mRNA und „small molecules“ (Lipoplexe, Polymernanopartikel)