Arbeitsgruppe Adulte Neurogenese und zelluläre Reprogrammierung
Wir beschäftigen uns einerseits mit den grundlegenden molekularen und zellulären Mechanismen der im erwachsenen Gehirn physiologisch vorkommenden Neurogenese sowie andererseits mit der Möglichkeit, die Neubildung von Nervenzellen dort, wo sie normalerweise nicht stattfindet, durch zelluläre Reprogrammierung zu induzieren.
Stammbaumentwicklung von adulten neuralen Stammzellen
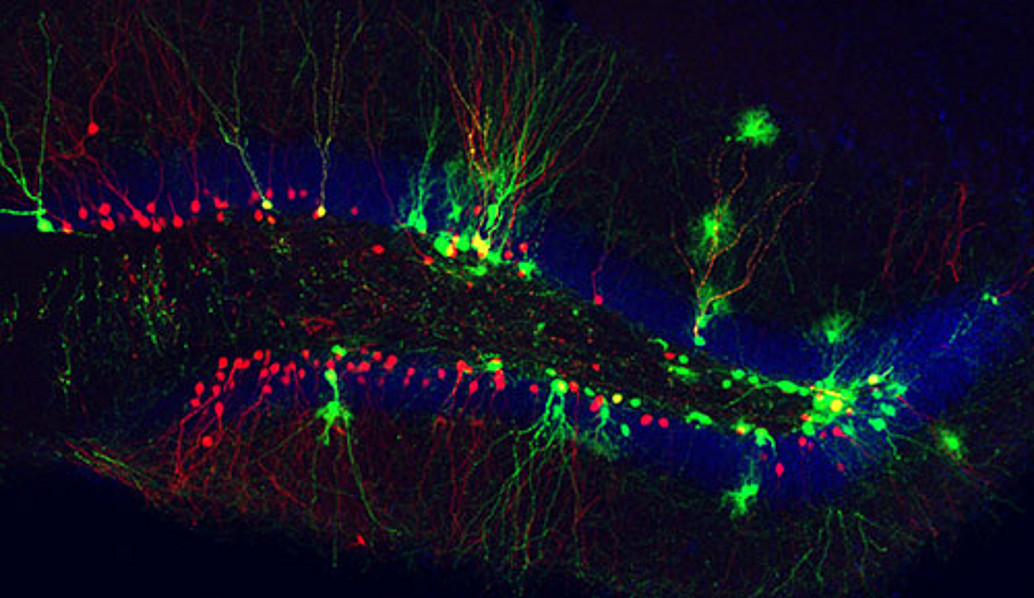
Zwei Regionen im Säugerhirn weisen zeitlebens die Neubildung von Nerven- und Gliazellen auf: die Subgranulärzone (so genannt, da sie sich genau unterhalb der Körnerzellschicht des Gyrus dentatus im Hippocampus befindet) sowie die Subventrikulärzone, welche sich an den zweiten Hirnventrikel anschmiegt. In beiden Regionen gibt es neurale Stammzellen, die sich einerseits selbst erneuern können, anderseits aber auch Nachkommen hervorbringen, die sich in verschiedene Typen von Nerven- und Gliazellen differenzieren. Zu letzteren gehören die Oligodendroglia, welche für die Bildung der Markscheiden verantwortlich ist, die Nervenfasern umhüllen und bei Erkrankungen wie Multiple Sklerose degenerieren. Wir untersuchen das Teilungsverhalten der Stammzellen sowie die Mechanismen, die regeln, ob eine undifferenzierte Zelle ein Neuron oder eine Gliazelle wird (Costa et al., 2011; Ortega et al., 2011). Eine Kernfrage, der wir intensiv nachgehen, ist, ob ein und dieselbe Stammzelle sowohl Neurone als auch Oligodendroglia produzieren kann. Mit Hilfe von Zeitraffer-Videomikroskopie konnten wir vor kurzem zeigen, dass in Zellkultur gehaltene neurale Stammzellen aus der adulten Subventrikulärzone entweder nur neuronale oder oligodendrogliale Nachkommen generieren, aber nicht beides zugleich (Ortega et al., 2013). Darüber hinaus fanden wir, dass die Neubildung von Oligodendroglia durch Stimulierung des Wnt-Signalweges selektiv angeregt werden kann. Dieser Befund konnte in der adulten Subventrikulärzone in vivo voll bestätigt werden. Diese Daten liefern möglicherweise einen wichtigen Hinweis darauf, wie die Neubildung von Oligodendroglia selektiv verstärkt werden kann, um in der Zukunft Erkrankungen wie Multiple Sklerose besser behandeln zu können.
http://www.youtube.com/watch?v=I2uu8oFTl7w
Das Video zeigt die Stammbaumentwicklung einer neuralen Stammzelle aus der Subventrikulärzone.
Das Video zeigt die Stammbaumentwicklung einer neuralen Stammzelle aus der Subventrikulärzone.
Integration von neugebildeten Neuronen in das bestehende neuronale Netz
Darüber hinaus beschäftigen wir uns auch mit der Frage, wie sich neugebildete Nervenzellen in ein bestehendes Nervenzellnetzwerk integrieren. Überraschenderweise sterben viele der neugebildeten Neurone vorzeitig ab (siehe Übersichtsartikel (Bergami and Berninger, 2012)). Um den Prozess der Integration neuer Nervenzellen besser verstehen zu können, haben wir eine Methode entwickelt, die es uns erlaubt, die synaptische Verknüpfung der neuen Neurone in vivo zeitlich zu verfolgen (Deshpande et al., 2013). Die in der Subgranulärzone gebildeten Nervenzellen wandern über eine kurze Distanz in die Körnerschicht ein, wo sie sich in sogenannte Körnerzellen differenzieren. Mittels eines modifizierten Tollwutvirus kann man nun zu unterschiedlichen Zeitpunkten untersuchen, welche Nervenzellen mit den neugebildeten Neuronen Kontakt aufnehmen und diese synaptisch innervieren. Dabei fanden wir, dass die neuen Neurone 1-2 Wochen nach ihrer Geburt zuerst von Nervenzellen in der direkten Nachbarschaft kontaktiert werden, nämlich von sogenannten lokalen Interneuronen. Weitere 1-2 Wochen später treffen auch synaptische Eingänge aus weiter entfernt gelegenen Hirnarealen ein, wie z.B. cholinerger Input aus dem medialen Septum. Erst am Ende ihres Reifungsprozesses (3-5 Wochen) werden neue Körnerzellen von Pyramidenzellen des Entorhinalen Kortex innerviert und werden somit ein Teil des klassischen tri-synaptischen hippocampalen Schaltkreises. Diese Sequenz der Innervation legt nahe, dass sich im Verlauf des Reifungsprozesses der funktionelle Einfluss der neuen Neurone auf die neurale Informationsverarbeitung im Hippocampus ändert.