Arbeitsgruppe Angewandte Molekularbiologie
Das Ziel der ERC Advanced Investigator Gruppe von Univ.-Prof. Dr. Dr. h. c. Werner E.G. Müller, die auch die Gruppen von Frau Prof. Dr. Xiaohong Wang, Prof. Dr. Dr. Heinz C. Schröder, Dr. Matthias Wiens und Dr. Meik Neufurth umfasst, ist es, neue Erkenntnisse in der Grundlagenforschung zu gewinnen, die in eine medizinische Anwendung überführt werden können.Von Biomolekülen zu Biomineralen: Evolution medizinisch relevanter Stoffwechselwege
Ausgangspunkt unserer gegenwärtigen Forschungsarbeiten sind unsere langjährigen Untersuchungen von Sekundärmetaboliten aus Schwämmen, eine der reichhaltigsten Quellen für neuartige, potenziell medizinisch anwendbare Substanzen im Meer. Hierbei gelang es uns unter anderem einen Inhibitor der Herpes simplex Virus DNA-Polymerase aufzufinden und dessen Mechanismus aufzuklären: araA, ein Virostatikum, das bis heute in klinischem Gebrauch ist. Ebenso konnte der Wirkmechanismus eines weiteren Nucleosid-Analogons, araC, geklärt werden, das in der Tumortherapie eingesetzt wird. Im Laufe dieser Arbeiten wurden von uns in Schwämmen grundlegende Stoffwechselwege und Mechanismen wie die der Apoptose aufgeklärt. Dies führte dazu, dass von uns auch die molekularen Grundlagen des Zelltods bei humanen Krankheiten, wie Morbus Alzheimer, HIV und Creutzfeldt-Jakob-Erkrankung, sowie der protektive Effekt bestimmter Arzneistoffe wie Memantine und Flupirtin geklärt werden konnten. Dabei wurde es immer deutlicher, dass die Stoffwechsel- und Stress-Response-Mechanismen bei Schwämmen ähnlich denjenigen bei Menschen sind. Dies führte letztendlich zur Entdeckung, dass alle Tiere monophyletischen Ursprungs sind.Biomineralisation – ein Enzym-katalysierter Prozess?
Eine grundlegende Frage war: Wie schaffen es Skelett-bildende Organismen, die Aktivierungsenergie zu überwinden, die bei Mineralisationsprozessen aufgebracht werden muss? Aus der Biochemie wissen wir, dass Enzyme die Aktivierungsenergie chemischer Reaktionen herabsetzen. Deshalb fragten wir: Ist auch die Bildung des Silikat-Skeletts (Glas-Skeletts) der Kieselschwämme enzymkatalysiert? In der Tat konnte dies von uns gezeigt werden. Das Schwamm-Protein Silicatein besitzt, wie wir zeigen konnten, die Fähigkeit, Silica (also ein anorganisches Material) über einen enzymatischen Mechanismus aus Orthosilikat (ebenfalls ein rein anorganisches Material) zu synthetisieren. Eine derartige Reaktion war bis dahin bei keinem anderen Enzym nachgewiesen worden – eine Entdeckung, die in einem ERC Advanced Grant Projekt („BIOSILICA“) des Arbeitsgruppenleiters im Detail untersucht wurde und sich nicht nur für technische (Silica ist ein Grundmaterial der Nanotechnologe), sondern auch für medizinische Anwendungen von großer Bedeutung erwies.
Als nächstes fragten wir: Ist auch die Bildung der Calciumcarbonat- und Calciumphosphat-Skelette enzymkatalysiert? Wir fanden, dass bei der Knochen-Mineralisierung initial nicht Hydroxylapatit, sondern amorphes Calciumcarbonat (ACC) gebildet wird, synthetisiert durch eine Carboanhydrase. Dieses wird anschließend durch Carbonat-Phosphat-Austausch in amorphes Calciumphosphat (ACP) und dann Hydroxylapatit umgewandelt. Das benötigte Phosphat wird – wiederum enzymatisch – durch die Hydrolyse anorganischer Polyphosphate (PolyP), katalysiert durch die alkalische Phosphatase (ALP), das Schlüsselenzym der Osteoblasten, geliefert.
Geweberegeneration: Wer liefert extrazellulär die Energie?
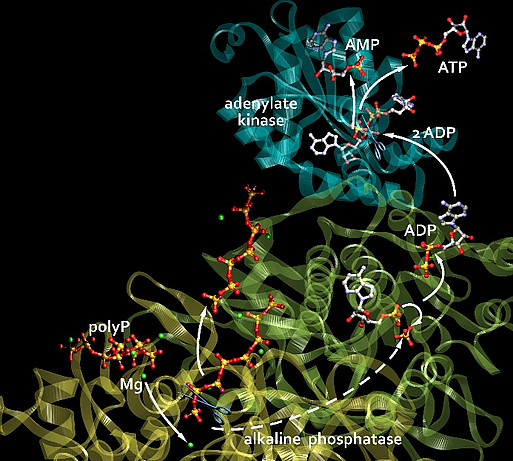
Eine extrazelluläre Energiequelle war bisher unbekannt – ATP, der universelle Energieträger, wird nur in minimalen Mengen aus Zellen freigesetzt. Wir fragten deshalb: Woher kommt diese Energie, wer liefert sie? Die Antwort ist: PolyP. Diese Polymere, die aus zahlreichen, über energiereiche Phosphoanhydrid-Bindungen miteinander verknüpften Phosphatresten bestehen, stellen nicht nur eine Phosphatquelle für die Knochenmineralisation dar, sondern dienen, wie wir fanden, generell als Speicher und -Donor metabolischer Energie insbesondere im Extrazellularraum. Wie konnten zeigen, dass die in PolyP gespeicherte Energie (ein Vielfaches der bei der Hydrolyse von ATP freigesetzten Energie) extrazellulär in biochemisch nutzbare Energie, in Form von ATP, umgewandelt werden kann, über die kombinierte Wirkung zweier Enzyme, der zellmembranständigen ALP und der Adenylatkinase (ADK).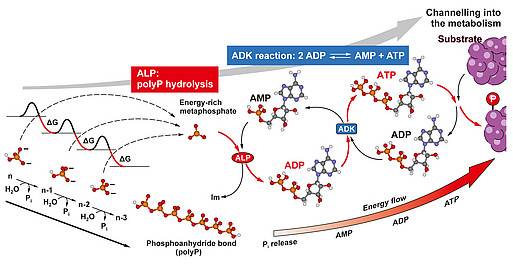
Entwicklung medizinischer Anwendungen
Die Aufklärung dieser ungewöhnlichen Eigenschaften der amorphen anorganischen Biomaterialien ACC, ACP, Silica sowie PolyP (als Nano-/Mikropartikel) ermöglichten uns die Entwicklung neuer Strategien für das Tissue Engineering und eine Anwendung in der regenerativen Medizin. Diese Materialien sind nicht nur regenerativ aktiv und bioabbaubar, sondern dienen, im Falle von PolyP, auch als Energielieferant – eine Eigenschaftskombination, die bisher von keinem anderen Material für das Tissue Engineering/Gewebereparatur gezeigt wurde. Mit Hilfe eines bioinspirierten Verfahrens gelang es uns, amorphe (nicht-kristalline, also biologisch aktive) Nano- und Mikropartikel des PolyP mit unterschiedlichen biologischen Eigenschaften herzustellen. Diese Nano-/Mikropartikel sind stabil und werden nach Umwandlung in ein Koazervat in Gegenwart von proteinhaltigen Körperflüssigkeiten (z.B. Wundsekret) biologisch aktiv: so zeigen beispielweise Ca-PolyP-Nano-/Mikropartikel nach Koazervatumwandlung eine stark stimulierende Wirkung auf die Knochen-Mineralisation.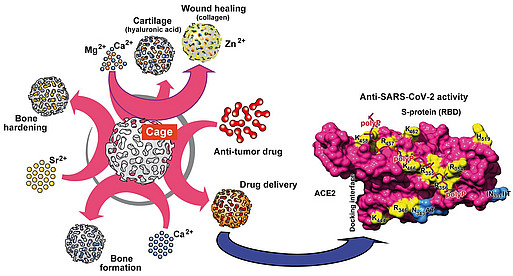
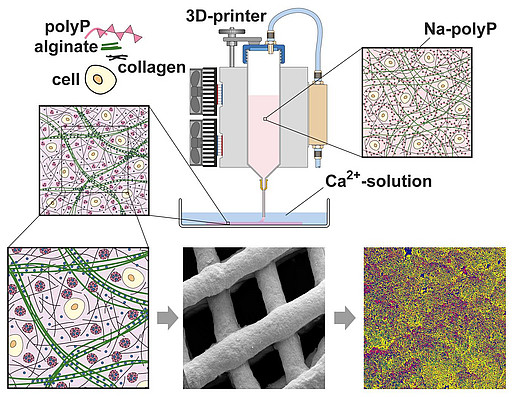
Durch Kombination von PolyP oder PolyP-Nano-/Mikropartikeln mit Hydrogel-bildenden Polymeren wie Alginat, Hyaluronsäure, Chitosanderivaten oder Chondroitinsulfat konnten von uns – u.a. auch 3D-druckbare – Hybridmaterialien für eine Reihe medizinischer Anwendungen entwickelt werden, von der Zahnversiegelung bis zu Wundheilungsmaterialien, zur Stimulierung der Mikrovaskularisation und Knochen- und Knorpel-Regeneration, sowie zur Herstellung künstlicher Blutgefäße und Korneas. Auch gelang es mit geeigneten Hydrogelen eine PolyP-basierte Bio-Tinte für den 3D-Zelldruck (3D-Bioplotting) zu entwickeln – die eingebetteten Zellen blieben proliferativ aktiv. Erste regenerativ aktive Implantatmaterialien wurden bereits im Tierversuch getestet und sollen in die klinische Anwendung gebracht werden.
Neben diesen im Rahmen von drei ERC-Proof-of-Concept-Grants ("Si-Bone-PoC", "MorphoVES-PoC" und "ArthroDUR") und einer Reihe weiterer von uns koordinierter EU Projekten geförderten Arbeiten werden von uns gegenwärtig in einem deutsch-chinesischen Projekt neuartige Wundheilungsmaterialien, insbesondere für chronische Wunden entwickelt. Wie andere regenerative Prozesse erfordert die Wundheilung viel Energie – ein Bedarf, der durch die PolyP-Komponente dieser Materialien gedeckt wird. Darüber hinaus induziert PolyP die Mikrovaskularisation. In Zusammenarbeit mit der Hautklinik der Universitätsmedizin konnte bereits an Patienten gezeigt werden, dass eine Wundauflage auf PolyP-Basis erfolgreich zur Heilung schwer heilender, chronischer Wunden eingesetzt werden kann. Weitere Forschungsarbeiten in dem EU Horizon 2020 Projekt („InnovaConcrete“) nutzen die stabilisierende Eigenschaft von PolyP auf ACC, um Zementen (sowohl technischen als auch medizinisch anwendbaren) selbstheilenden Eigenschaften zu verleihen.
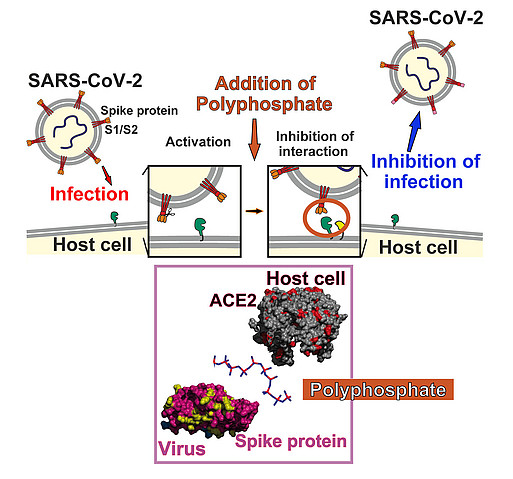
Antivirale Substanzen gegen SARS-CoV-2
Polyphosphate sind nicht nur morphogenetisch aktiv, sonders besitzen auch antivirale Eigenschaften. Dies konnte von uns bereits früher bei HIV-1-infizierte Zellen gezeigt werden. Jetzt konnten wir in Modell-Systemen zeigen, dass PolyP protektiv gegenüber dem Coronavirus SARS-CoV-2 wirkt. PolyP bindet an die Rezeptorbindungsdomäne der Spike-Proteine von SARS-CoV-2 und blockiert dadurch deren Anheftung an das Wirtszell-Rezeptorprotein ACE-2. Und nicht nur das: PolyP induziert die Expression von Mucin-Proteine, die die schützende Mukusschicht aufbauen, welche die Viren durchqueren müssen, um die Zellen des Epithels des Nasen-Rachen-Raums zu erreichen.