Molekulare Tumorbiologie
Beispielhafte Projekte1. Untersuchung der Mediatoren von Radioresistenz und Seneszenz in der komplexen Tumormikroumgebung
Verschiedene Proteine (hnRNPK, NPM1, HSP27, …), oftmals Phosphoproteine, untersuchen wir hinsichtlich ihrer Rolle bei der Reaktion auf strahleninduzierte Zellschäden und assoziierte Reparaturmechanismen in Tumorzellen in vitro und in ovo. Sie wurden in frühen Proteomanalysen mittels 3D-Gelektrophorese und MALDI-TOF-Massenspektrometrie identifiziert. Ihre Phosphorylierung oder auch Dephosphorylierung ermöglicht den Tumorzellen eine schnelle Reaktion nach Bestrahlung. Im Rahmen der Resistenzentwicklung ist auch die Seneszenz in den Fokus gerückt. Seneszente Tumorzellen befinden sich in einem Ruhemodus und proliferieren zunächst nicht mehr, können in den Zellzyklus jedoch wieder eintreten und so Rezidive bilden. Mit konventionellen Therapien sind diese ruhenden Tumorzellen schwer bis gar nicht angreifbar. Wir wollen genauer untersuchen, wie es zur Entwicklung von Seneszenz kommt und wie die beteiligten Mechanismen unterbunden werden können. Bei der Entstehung und Progression von Tumoren ebenso wie bei der Entstehung von Therapieresistenzen spielen neben den Tumorzellen selbst auch das Tumormikromilieu und darin besonders die tumorassoziierten Fibroblasten (CAFs) eine wichtige Rolle. Die wechselseitige Kommunikation zwischen den Tumorzellen und der Tumormikroumgebung sowie die Interaktion mit dem Immunsystem sind mitbestimmend für das proliferative und migratorische Potential eines Tumors. Neben der Untersuchung der CAFs gilt unsere Aufmerksamkeit darüber hinaus den Tumor-assoziierten Makrophagen (TAMs). Im Zuge der Radiotherapie werden auch CAFs und TAMs der Strahlung ausgesetzt. Dies führt zu Veränderungen des sekretorischen Potentials, der Induktion von Seneszenz sowie zu Veränderungen des proliferativen und migratorischen Verhaltens dieser Zellen und kann so das Therapieansprechen des Tumors wesentlich mitbestimmen.
2. Analyse der Tumorvaskularisation nach Radiatio und antiangiogener Therapie
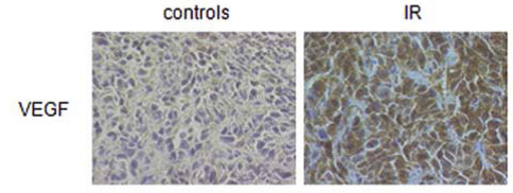
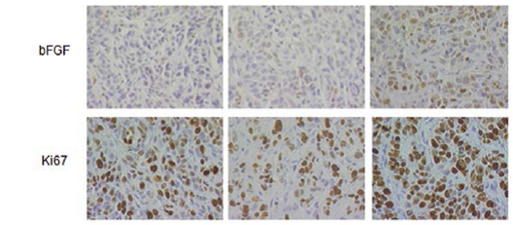
Wir untersuchten im Mausxenotransplantatmodell die Vascularisierung und Perfusion von SCC unter Radiatio. Hierzu wurde den Tieren unter die Haut ein Tumor implantiert und die Gefäßdichte und Durchblutung mittels immunohistochemischer Anfärbung und funktioneller Bildgebung (Ultraschall und MRT) untersucht. Wir konnten so die Freisetzung von VEGF nach Radiatio sowie die nachfolgende Stabilisierung des Gefäßnetzes nachweisen.
3. Mechanismen der Zn-Toxizität
Zink ist ein lebensnotwendiges Spurenelement kann aber auch toxische Reaktionen hervorrufen (bekannt als „Schweisserfieber“). Wir wollten daher wissen, wie Zinktoxizität entsteht und ob man ggf. diese gezielt gegen Tumorzellen richten kann. Wir konnten lernen, dass ZnO- Nanopartikel in die Zellen aufgenommen werden, aber auch außerhalb zerfallen und als Ionen in die Zelle gelangen. Dort scheinen sie die Mitochondrien zu schädigen, was zur Freisetzung von ROS (Sauerstoffradikalen) führt. Diese schädigen dann die DNA und andere Zellbestandteile. Alles zusammen führt bei entsprechender Dosis zur Apoptose. Wir konnten außerdem zeigen, dass gesunde Zellen weniger sensitive als Tumorzellen auf Zn reagieren. Diese Daten machen Hoffnung, dass ZnO-Nanopartikel sich für die Tumortherapie einsetzen lassen.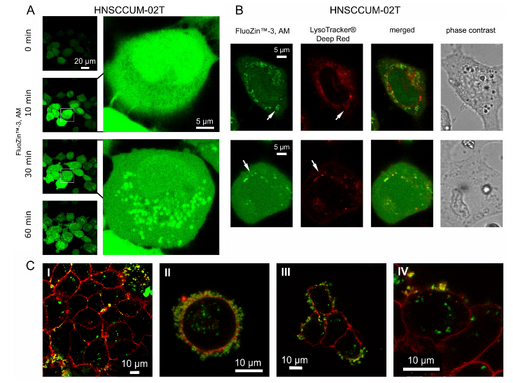
4. Kaltes atmosphärisches Plasma (CAP) in der Tumortherapie
Seit die Erzeugung von physikalischem Plasma bei normalem atmosphärischem Druck und Raumtemperatur möglich ist, haben sich eine Vielzahl von potenziellen Anwendungen in der Medizin ergeben. Sie zielen bislang meist auf die antimikrobielle, durchblutungsfördernde und die regenerative Wirkung ab. Zudem wurde eine antikanzeröse Wirkung von CAP in vitro nachgewiesen, welche auf reaktive Sauerstoff- und Stickstoffspezies zurückgeführt wird. Da über die Wirkung von CAP in vivo bisher sehr wenig bekannt ist, untersuchen wir den Einfluss von CAP auf Tumore in der Chorionallantoismembran (CAM). Hierbei analysieren wir auch wie CAP, dazu eingesetzt werden kann bestehende Tumortherapien effizienter und nebenwirkungsärmer zu machen. Dazu kombinieren wir CAP beispielsweise mit Chemotherapeutika und untersuchen im CAM-Assay unterschiedliche Behandlungsszenarien und ihren Einfluss auf die Proliferation, die Apoptosen im Tumor sowie die Tumorvaskularisation.
5. 3D-gedruckte Polylactid-Knorpel-Implantate für den individualisierten chirurgischen Verschluss von Septumperforationen
Eine Vielzahl von Krankheitsbildern fußt auf einem Mangel an Knorpelsubstanz. Im Bereich der HNO sind dies Knorpeldefekte in Form von traumatisch- oder malignom-bedingten Substanzdefekten. Dabei ist die Septumperforation das am häufigsten diagnostizierte Krankheitsbild. Therapieoptionen umfassen neben der symptomatischen Therapie den Einsatz von Septumepithesen und chirurgisch-rekonstruktive Verfahren. Die begrenzte Menge an verfügbarem, qualitativ hochwertigem Septumknorpel für den Strukturerhalt ebenso wie dessen Bradytrophie und die rein passive Ernährung über Diffusion stellen offenkundige Herausforderungen bei der chirurgischen Rekonstruktion dar. Ziel des Projekts ist es, struktur-stabile, individuell anpassbare, 3D-gedruckte Polylactid-Implantate mit Chondrozyten zu besiedeln. Diese sollen nachfolgend für den Defektverschluss bei Septumperforationen eingesetzt werden können. Dieses Projekt wird in Kooperation mit dem Zentrum für Orthopädie und Unfallchirurgie der Universitätsmedizin Mainz durchgeführt.