Identifizierung und Charakterisierung neuer Faktoren der Proteostase und des Autophagienetzwerkes
Die Aufrechterhaltung der Proteinhomöostase, also eines Gleichgewichts zwischen der Synthese, Faltung und kontrollierten Degradation von Proteinen, ist für die Funktion jeder Zelle von entscheidender Bedeutung. Die Degradation fehlgefalteter, geschädigter, dysfunktioneller oder aggregierter Proteine kann dabei grundsätzlich über zwei Mechanismen erfolgen: das Ubiquitin-Proteasom-System sowie die Makroautophagie, die eine Gruppe von Einzelprozessen darstellt, die den Abbau cytoplasmatischer Makromoleküle mit Hilfe von Lysosomen beschreibt. Im Zuge der Makroautophagie werden z.B. Proteinaggregate oder Zellorganelle in Membranvesikel, sog. Autophagosomen, verpackt, die dann mit Lysosomen fusionieren.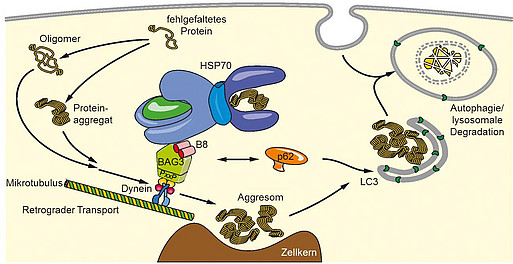
Wir konnten in unterschiedlichen Modellsystemen zeigen, dass die Zelle im Zuge der Alterung - wie auch als Antwort auf akuten proteotoxischen Stress - ihre Proteindegradationsmechanismen umorganisiert und vom proteasomalen auf den Autophagie-Weg verlagert. Dies bewerkstelligt sie über die reziproke Regulation der Co-Chaperone BAG1 und BAG3 („BAG1/BAG3-Switch“) und passt sich mit der von uns erstmals beschriebenen „BAG3-vermittelten selektiven Makroautophagie“ dem oxidativen, proteotoxischen Milieu an, das mit der Alterung einhergeht. Auf molekularer Ebene konnten wir BAG3 als diejenige Komponente identifizieren, die fehlerhafte Proteine von dem Chaperon HSP70, das sie als solche erkennt, auf das Motorprotein Dynein transferiert. Auf diese Weise ermöglicht BAG3 ihren Transport zum sog. Aggresom, einer perinukleären Struktur, in der für den Abbau vorgesehene Proteine konzentriert werden. Die Kinetik dieses Prozesses, die Regulation der BAG3-vermittelten selektiven Makroautophagie durch endo- und exogene Faktoren sowie post-translationale Modifikationen und das Zusammenspiel mit anderen Autophagiewegen untersuchen wir im Rahmen des Sonderforschungsbereichs 1177 (federführend: Christian Behl).
Ein weiterer Fokus unserer Arbeiten besteht in der Identifizierung neuer Faktoren der Proteostase mit Hilfe spezifischer C. elegans-Reporterlinien und RNAi-Bibliotheken. Im Zuge dieses RNAi-Screens konnten wir den RAB3GAP-Komplex als neuen Faktor der Autophagie charakterisieren, der für die Bildung von Autophagosomen benötigt wird. RABGAP-Proteine sind Komponenten des zellulären Vesikeltransportsystems und koordinieren über die Regulation von RAB GTPasen unterschiedliche Transportwege. Eine zentrale Herausforderung der Autophagie ist, die Verfügbarkeit von Membranen zu gewährleisten, die notwendig sind, um Autophagosomen in ausreichendem Maß zu bilden. An dieser frühen Phase der Autophagie ist der RAB3GAP-Komplex entscheidend beteiligt, was dazu führt, dass sein Fehlen eine Verminderung der autophagischen Aktivität bewirkt, wohingegen sein verstärktes Auftreten die Autophagie fördert. Als positiver Modulator der Autophagie beeinflusst der RAB3GAP-Komplex die Proteinhomöostase und eine Fehlfunktion hat eine erhöhte Proteinaggregation zur Folge. Derzeit arbeiten wir an der Aufklärung der spezifischen Zielstrukturen und der Regulation dieses Proteinkomplexes (federführend: Andreas Kern).
Eine veränderte Regulation der Proteinhomöostase im Zuge der zellulären Alterung ist in verschiedenen Systemen beschrieben, bisher aber nur teilweise verstanden. Eine der zentralen Fragen ist es, welche Faktoren, wie z.B. die dauernde Präsenz mutanter Proteine, diese veränderte Regulation herbeiführen. Ausgehend von dem oben erwähnten RNAi-Screen in C. elegans haben wir RME-8 (Ortholog in Säugern: DNAJC13) als Faktor identifiziert, dessen Fehlen die Aufrechterhaltung der Proteinhomöostase beeinträchtigt und die Aggregation von Reporterproteinen fördert. RME-8, das ursprünglich als "receptor mediated endocytosis 8" beschrieben wurde, interagiert mit dem Retromer-Komplex und ist in einer Reihe von Transportprozessen zum und vom Endosom beteiligt. Wir konnten nun zeigen, dass ein Fehlen von RME-8 in humanen Zellen die Proteostase stört und bei akutem Stress zu Proteinaggregation führt. In derzeitigen Untersuchungen erarbeiten wir, welche Funktion RME-8 als mögliches Bindeglied zwischen dem endosomalen Transportsystem und der Aufrechterhaltung der Proteinhomöostase ausübt. Weiterhin untersuchen wir in zellulären Alterungsmodellen wie primären humanen Fibroblastenlinien von Patienten mit Amyotropher Lateralsklerose, welche Rolle RME-8 bei der Regulation der Proteostase spielt. Dieses Projekt ist Teil des SFB 1080 (TPA8 Clement/Behl) und wird in Kooperation mit dem Deutschen Netzwerk für Motoneuronerkrankungen (MND-NET, BMBF) durchgeführt (federführend: Albrecht Clement).
Auch bei akuten degenerativen Prozessen wird ein Einfluss der Proteostase diskutiert, denn beim Schädelhirntrauma wird das Ausmaß der funktionellen Schädigung v.a. durch die Expansion der primären Läsion in das umgebende gesunde Hirngewebe bestimmt. Entscheidend für die Eindämmung ist die funktionelle Reorganisation der Gehirnzellen in den benachbarten Arealen. Zu den adaptiven Prozessen, die in Nerven- und Gliazellen ablaufen, gehört die Stabilisierung der Proteinhomöostase und hierbei der Abbau geschädigter, dysfunktioneller und aggregierter Proteine. Das Ziel dieses Kooperationsprojektes (zwischen der Klinik für Anästhesiologie, dem Institut für Physiologie und Pathophysiologie, sowie dem Institut für Pathobiochemie), das ebenfalls Teil des SFB 1080 ist (TPA7 Behl/Engelhard/ Mittmann), ist es, die Veränderungen der Proteostase nach Schädelhirntrauma im Detail zu verstehen und den Zusammenhang der funktionellen Reorganisation mit dem Überleben der Neuronen aufzuzeigen. Dazu wird in in vivo-Modellen des Schädelhirntraumas ein räumliches und zeitliches Profil der verschiedenen Proteinabbauwege erstellt und mit der neuronalen Funktion, die mittels Feldpotential- und Einzelzell-Ableitungen bestimmt wird, korreliert. Der Schwerpunkt liegt dabei zunächst auf der BAG3-vermittelten selektiven Makroautophagie (federführend: Christian Behl).