Arbeitsgruppe "Evolutionäre Biochemie und Redox-Medizin"
Univ.-Prof. Dr. rer. nat. Bernd Moosmann
Wir interessieren uns für die Prinzipien und die Entstehung der modernen Redox-Biochemie. Alle modernen molekularen Strukturen und Stoffwechselwege sind durch evolutionäre Veränderungen über lange Zeiträume hinweg entstanden. Ein tieferes Verständnis für diese Veränderungen und ihre Unterschiedlichkeit beispielsweise in unterschiedlichen Tierarten könnte einen signifikanten Beitrag dazu leisten, auch krankheitsverursachende Veränderungen im Menschen besser zu verstehen. In dieser Hinsicht erforschen wir insbesondere den biologischen Alterungsprozeß sowie die Entstehung von metabolischen und neurodegenerativen Erkrankungen.
Unsere Projekte:
1. Neurodegeneration und die biologische Alterung
Oxidativer Streß und eine fehlerhafte Redox-Regulation sind Charakteristika des biologischen Alterungsprozesses und treten verfrüht und in besonderer Weise bei neurodegenerativen Erkrankungen wie der Alzheimerschen Krankheit auf. Es ist jedoch nach wie vor unklar, inwieweit Oxidativer Streß auch eine in der Tat kausale Rolle bei der Alterung oder der Krankheitsentstehung spielt. Im Falle einer echten Kausalität bestünde die Möglichkeit, daß redoxmodulatorische Substanzen präventiv oder therapeutisch wirksam sein können.
Um zu einem besseren Verständnis potentiell kausaler Redox-Prozesse zu gelangen, arbeiten wir an einer systematischen Analyse der biochemischen Schadmuster im jungen, alten und erkrankten Gehirn und untersuchen dabei den möglichen Einfluß entwicklungsabhängiger Prozesse sowie der Neurotransmission auf diese Schadmuster. Zur Untersuchung von Redox-Schadmustern während der Alterung setzen wir Invertebraten-Modelle wie Nematoden und Fruchtfliegen ein.
-
Sohre S, Moosmann B (2018). The pathological hallmarks of Alzheimer’s disease derive from compensatory responses to NMDA receptor insufficiency. BioRxiv 418566.
-
Kunath S, Moosmann B (2020). What is the rate-limiting step towards aging? - Chemical reaction kinetics might reconcile contradictory observations in experimental aging research. Geroscience 42, 857-866.
-
Kunath S, Schindeldecker M, De Giacomo A, Meyer T, Sohre S, Hajieva P, von Schacky C, Urban J, Moosmann B (2020). Prooxidative chain transfer activity by thiol groups in biological systems. Redox Biol. 36, 101628.
-
Moosmann B (2021). Flux control in the aging cascade. Aging 13, 6233-6235.
-
Moosmann B, Hajieva P (2022). Probing the role of cysteine thiyl radicals in biology: eminently dangerous, difficult to scavenge. Antioxidants 11, 885.
Oskar-Fischer-Preis für Bernd Moosmann
Mehr zum Oskar-Fischer-Preis für Alzheimerforschung von der UTSA
2. Evolutionäre Proteom-Biochemie und der Ursprung des Lebens
Die Sequenzierung vieler vollständiger Genome in den letzten beiden Jahrzehnten hat zu einer Fülle an molekularen Daten über alle Arten des Lebens geführt. Die funktionelle und vergleichende Interpretation dieser Daten steht jedoch bislang in keinem Verhältnis zur akkumulierten Datenmenge.
Durch gezielte bioinformatische Analysen auf Genom- und Proteomebene sowie durch quantenchemische Berechnungen versuchen wir, neue und generelle Aussagen über die Evolution des Lebens auf der Erde abzuleiten. Unser besonderes Interesse gilt hierbei der Evolution des Genetischen Codes sowie der prinzipiellen Entstehung der chemischen Vielfalt, die besonders in der ungeheuren Vielzahl an Sekundärmetaboliten in Pflanzen und Mikroben sichtbar wird. Unsere Berechnungen könnten eines Tages für die Detektion von neuen Lebensformen auf anderen Planeten nützlich sein.
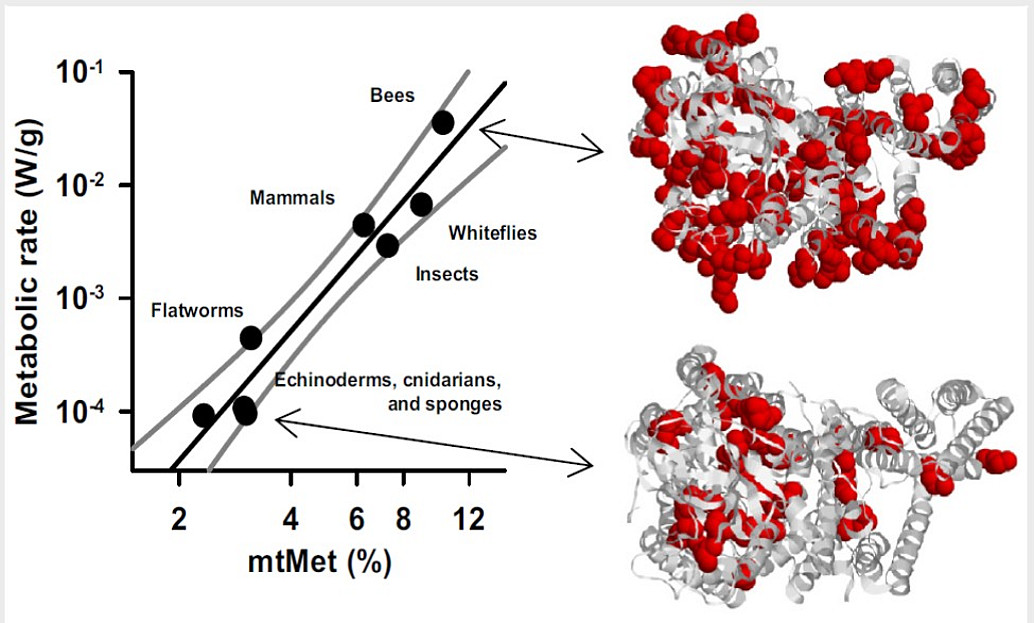
-
Granold M, Hajieva P, Tosa M, Irimie FD, Moosmann B (2018). Modern diversification of the amino acid repertoire driven by oxygen. Proc. Natl. Acad. Sci. USA 115, 41-46.
-
Moosmann B (2021). Redox biochemistry of the genetic code. Trends Biochem. Sci. 46, 83-86.
-
Schindeldecker M, Moosmann B (2024). Cysteine is the only universally affected and disfavored proteomic amino acid under oxidative conditions in animals. Antioxidants 13, 267.
-
Abrosimov R, Moosmann B (2024). The HOMO-LUMO gap as discriminator of biotic from abiotic chemistries. Life 14, 1330.
3. Regulation des Redox-Stoffwechsels
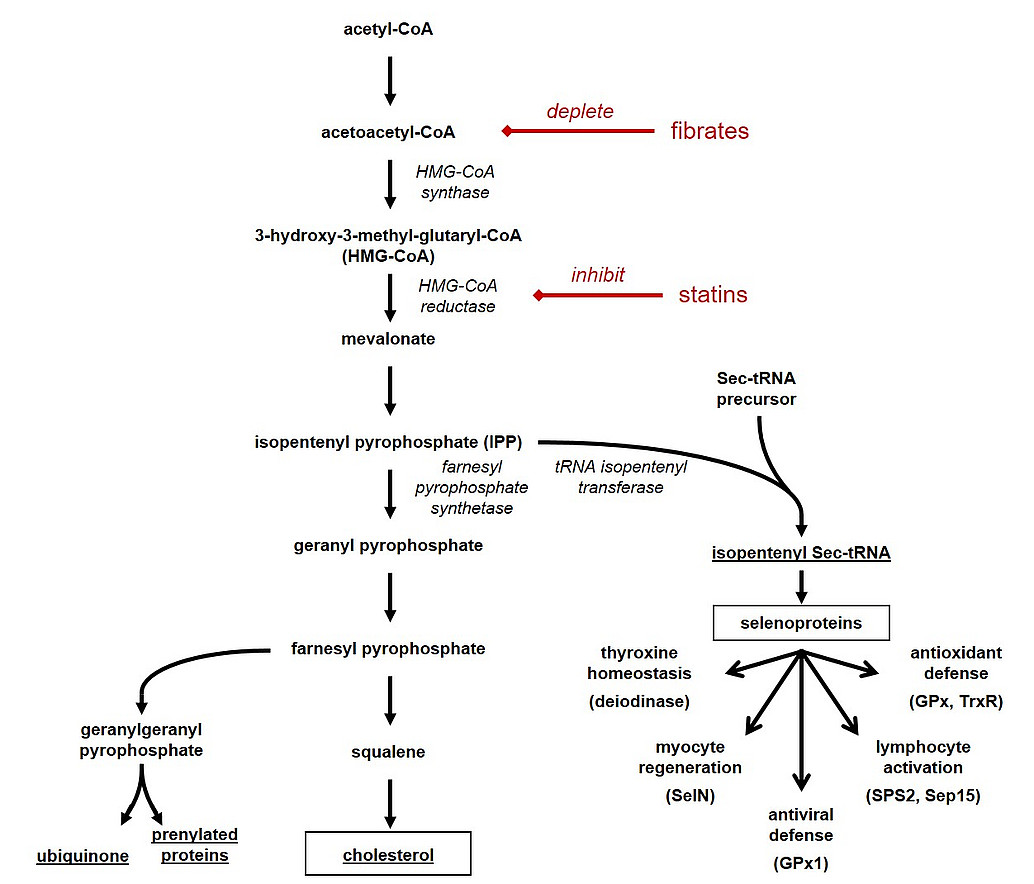
Jenseits seiner Rolle als essentielle Membrankomponente und Vorläufer von Steroidhormonen ist Cholesterol schon seit längerem als prooxidatives Effektormolekül bekannt. Möglicherweise trägt diese Wirkung zur Assoziation sehr hoher Cholesterolspiegel mit diversen Krankheiten wie der Atherosklerose bei. Cholesterolsenkende Pharmaka (Statine), welche die endogenes Synthese von Cholesterol hemmen, werden in der Literatur jedoch – je nach der im einzelnen untersuchten Patientenkohorte – sowohl als antioxidative wie auch als prooxidative Moleküle beschrieben. Wir vermuten, daß diese scheinbare Widersprüchlichkeit ihre Ursache in der außergewöhnlich gewebsspezifischen und variablen Modulation der Selenoprotein-Synthese durch Cholesterol haben könnte. Dieser Arbeitshypothese gehen wir in verschiedenen zellulären und genetischen Modellen nach.
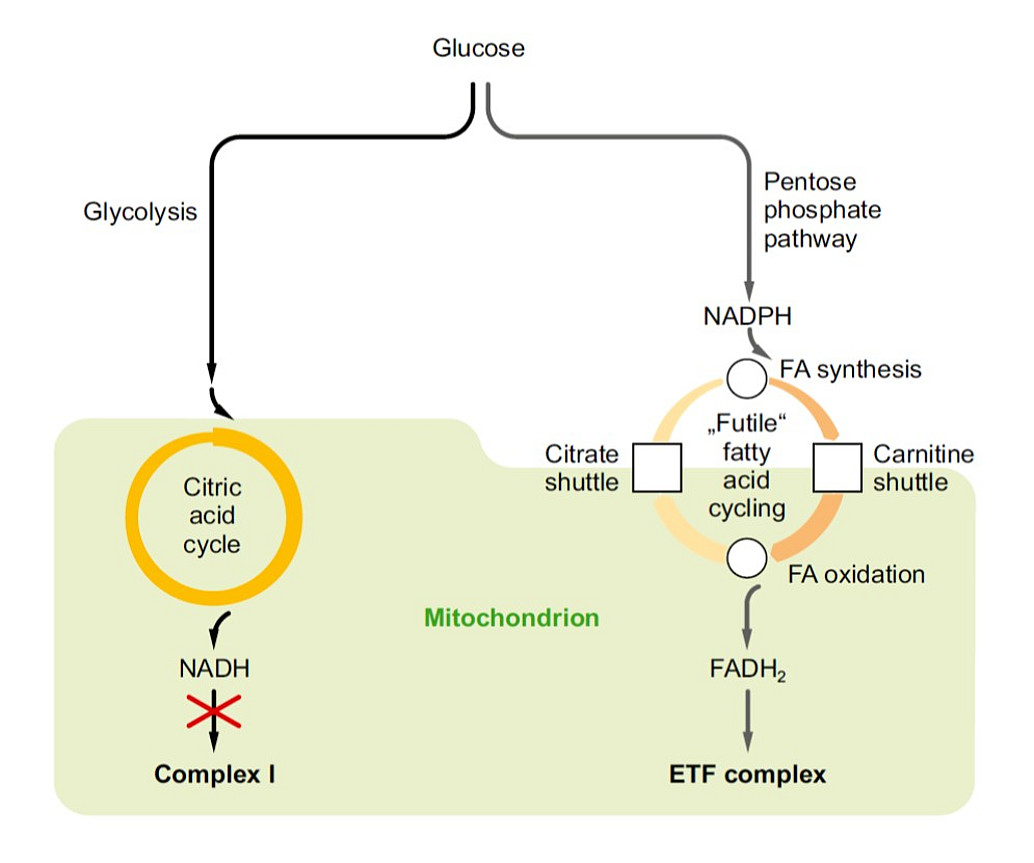
Verschiedene antidiabetische Strategien wie eine Verringerung der Methioninaufnahme mit der Nahrung oder eine pharmakologische Behandlung mit Metformin oder mit Fibraten und Glitazonen führen zu einer Hemmung des Atmungskettenkomplexes I. Obwohl diesem Effekt höchstwahrscheinlich kausale Bedeutung zukommt, existiert bislang kein allgemein akzeptiertes Modell dafür, wie eine hepatische Komplex I-Hemmung die Entstehung von Diabetes Typ II verhindert. Durch vergleichende Analyse der transkriptomischen und metabolomischen Effekte der Komplex I-Hemmung in verschiedenen experimentellen Systemen versuchen wir, dieses Rätsel zu lösen.
-
Kromer A, Moosmann B (2009). Statin-induced liver injury involves cross-talk between cholesterol and selenoprotein biosynthetic pathways. Mol. Pharmacol. 75, 1421-1429.
-
Fuhrmeister J, Tews M, Kromer A, Moosmann B (2012). Prooxidative toxicity and selenoprotein suppression by cerivastatin in muscle cells. Toxicol. Lett. 215, 219-227.
-
Baeken MW, Kötzner P, Richly H, Behl C, Moosmann B, Hajieva P (2023). Adaptive epigenetic regulation of neuronal metabolism by a mitochondrial redox signal. BioRxiv 570533.
-
Abrosimov R, Baeken MW, Hauf S, Wittig I, Hajieva P, Perrone CE, Moosmann B (2024). Mitochondrial complex I inhibition triggers NAD+-independent glucose oxidation via successive NADPH formation, “futile” fatty acid cycling, and FADH2 oxidation. Geroscience 46, 3635-3658.