Arbeitsgruppe "Molekulare Neurodegeneration"
Univ.-Prof. Dr. rer. nat. Claus Pietrzik
In unserer Arbeitsgruppe werden molekulare und biochemische Grundlagen der Neurodegeneration erarbeitet, wobei die Alzheimer Krankheit als Modellsystem dient. Mittels Zellkultur und verschiedener Tiermodelle werden die pathobiochemischen Abläufe, welche die Alzheimer Krankheit auslösen oder deren Verlauf begleiten, untersucht.
Dabei werden sowohl grundlegende biochemische Prozesse der Krankheitsentstehung und des Krankheitsverlaufs untersucht, als auch mögliche neuartige therapeutische Ansatzpunkte betrachtet.
Bei der Alzheimer Krankheit handelt es sich um eine neurodegenerative Erkrankung, die durch eine graduelle kognitive Abnahme charakterisiert ist und in einer späteren Demenz endet. Ursächlich für den Ausbruch der Krankheit sind der Verlust von Synapsen und der verstärkte neuronale Zelltod. Das pathologische Erscheinungsbild, das mit der Neurodegeneration einhergeht, zeigt intrazelluläre neurofibrilläre Versteifungen (Tangles) und extrazelluläre amyloide Ablagerungen (Plaques) in den Gehirnen betroffener Menschen. Derzeit sind weltweit ca. 15 % der über 65-jährigen und über 50 % der über 80-jährigen von der Alzheimer Krankheit betroffen. Schätzungen zufolge leben demnach zurzeit weltweit etwa 36 Millionen Menschen mit der Alzheimer Krankheit oder einer anderen Form von Demenz. Laut Prognosen wird diese Zahl bis 2030 auf etwa 65 Millionen und 2050 sogar auf rund 115 Millionen Patienten weltweit ansteigen.
In unserer Arbeitsgruppe werden derzeit folgende Themengebiete intensiv bearbeitet:
Bei der Alzheimer Krankheit handelt es sich um eine neurodegenerative Erkrankung, die durch eine graduelle kognitive Abnahme charakterisiert ist und in einer späteren Demenz endet. Ursächlich für den Ausbruch der Krankheit sind der Verlust von Synapsen und der verstärkte neuronale Zelltod. Das pathologische Erscheinungsbild, das mit der Neurodegeneration einhergeht, zeigt intrazelluläre neurofibrilläre Versteifungen (Tangles) und extrazelluläre amyloide Ablagerungen (Plaques) in den Gehirnen betroffener Menschen. Derzeit sind weltweit ca. 15 % der über 65-jährigen und über 50 % der über 80-jährigen von der Alzheimer Krankheit betroffen. Schätzungen zufolge leben demnach zurzeit weltweit etwa 36 Millionen Menschen mit der Alzheimer Krankheit oder einer anderen Form von Demenz. Laut Prognosen wird diese Zahl bis 2030 auf etwa 65 Millionen und 2050 sogar auf rund 115 Millionen Patienten weltweit ansteigen.
In unserer Arbeitsgruppe werden derzeit folgende Themengebiete intensiv bearbeitet:
1. Wir interessieren uns für die Prozessierung des Amyloid Precursor Protein (APP) und die physiologische Funktion der entstehenden Metaboliten.
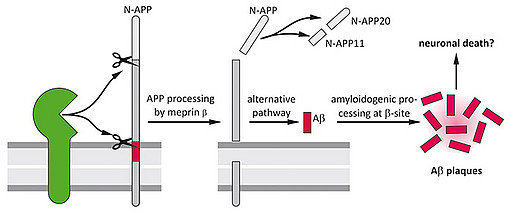
Die Amyloid Vorläufer Protein (APP)-Familie umfasst Typ I Transmembran Proteine, deren physiologische Funktionen noch weitestgehend ungeklärt sind. Vor kurzem konnte unsere Gruppe zeigen, dass APP bereits im Endoplasmatischen Retikulum Homodimere bildet, wodurch auch die Lokalisation und Prozessierung von einem weiteren Familienmitglied, APLP1, beeinflusst wird (Isbert et al. 2012, Journal of Cellular and Molecular Life Sciences). Die pathophysiologischen Eigenschaften von APP sind während der letzten Dekade umfassend untersucht worden, wobei die Freisetzung des Amyloid-β (Aβ) Peptides durch die proteolytische Spaltung von APP nach wie vor als eine der Hauptursachen für die Alzheimer Demenz (AD) gilt. Die Generierung des Aβ-Peptides stellt einen komplexen Prozess dar, an welchem verschiedene Sekretasen beteiligt sind. Als Hauptenzym, welches den N-Terminus von Aβ generiert, wurde die β-Sekretase BACE1 (β-site APP cleaving enzyme) identifiziert.
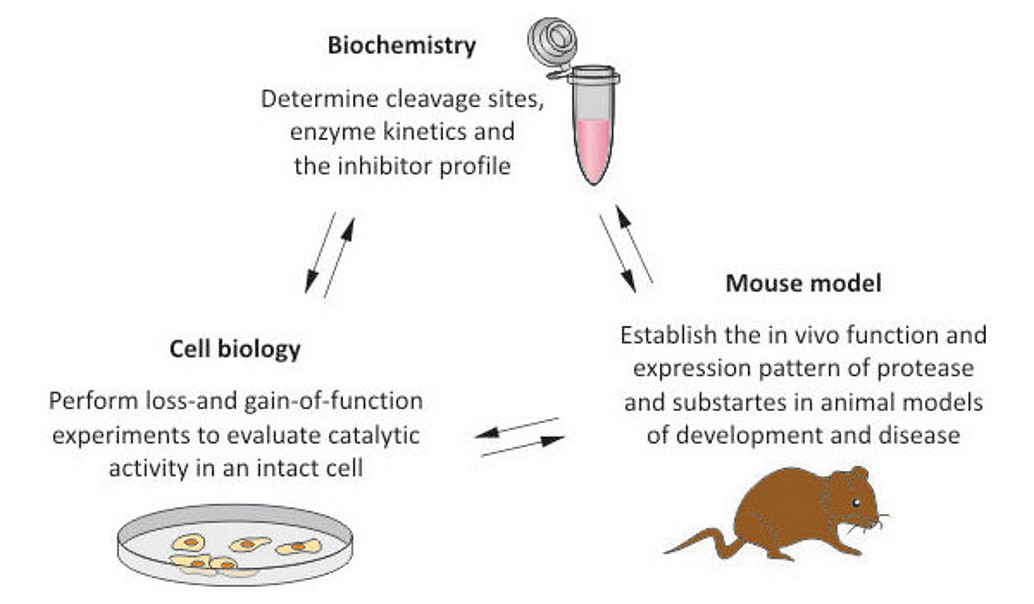
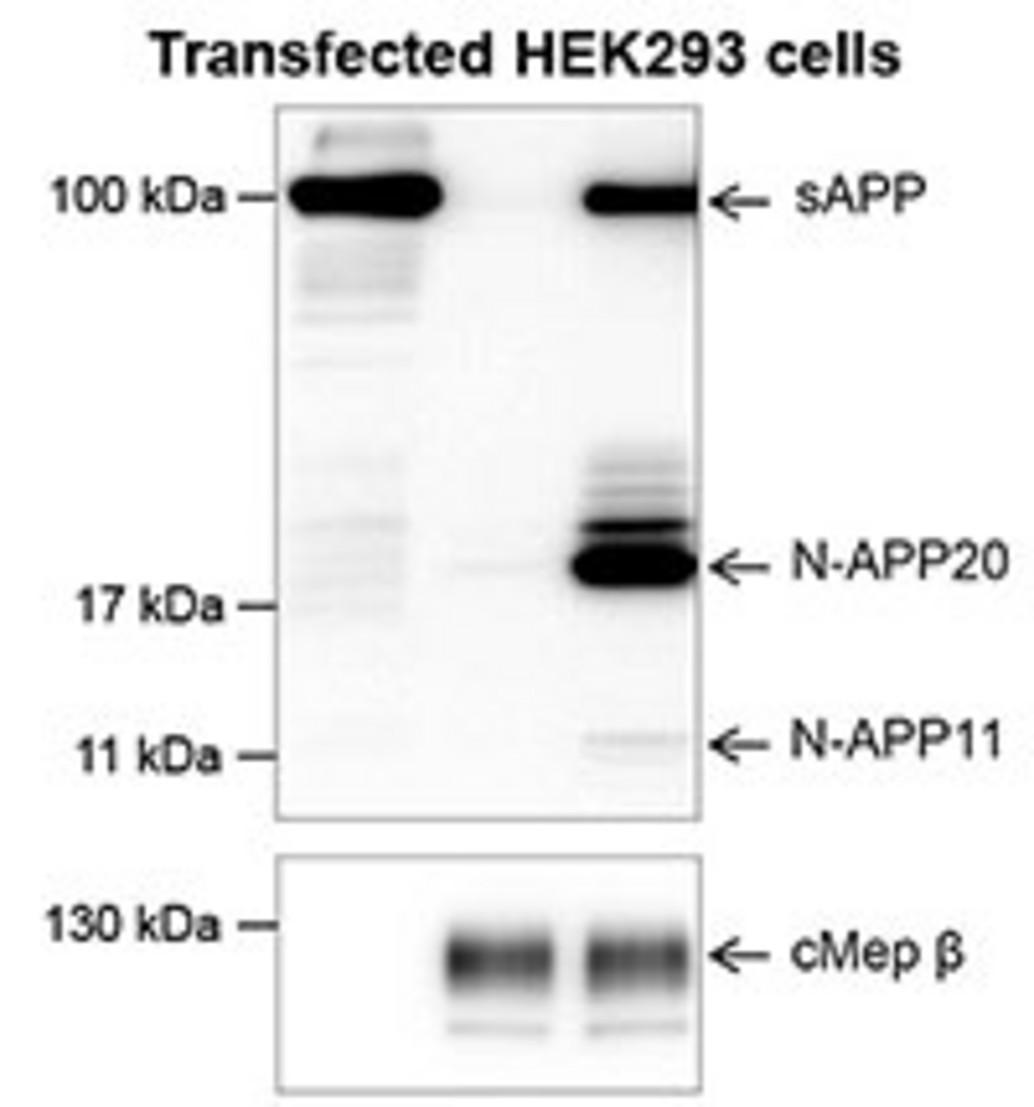
Vor kurzem konnten wir mit Hilfe von Proteom Analysen eine physiologisch relevante Interaktion zwischen der Metalloprotease Meprin β, einem Mitglied der Astacin Familie von Zink-Peptidasen, und APP identifizieren (Kollaboration mit Prof. Christoph Becker-Pauly, Universität zu Kiel). Basierend auf Zellkultur-Experimenten konnten wir bestätigen, dass APP tatsächlich ein Substrat für Meprin β in vivo darstellt. Derzeit untersuchen wir die funktionelle Rolle von Meprin β in der Alzheimer Erkrankung. Das Enzym scheint eine β-Sekretase-Aktivität aufzuweisen, wenn es zusammen mit APP in eukaryotischen Zellsystemen überexprimiert wird, wodurch unterschiedlich lange N-terminale APP-Fragmente in-vitro und in-vivo generiert werden (Jefferson et al. 2011, Journal of Biological Chemistry).
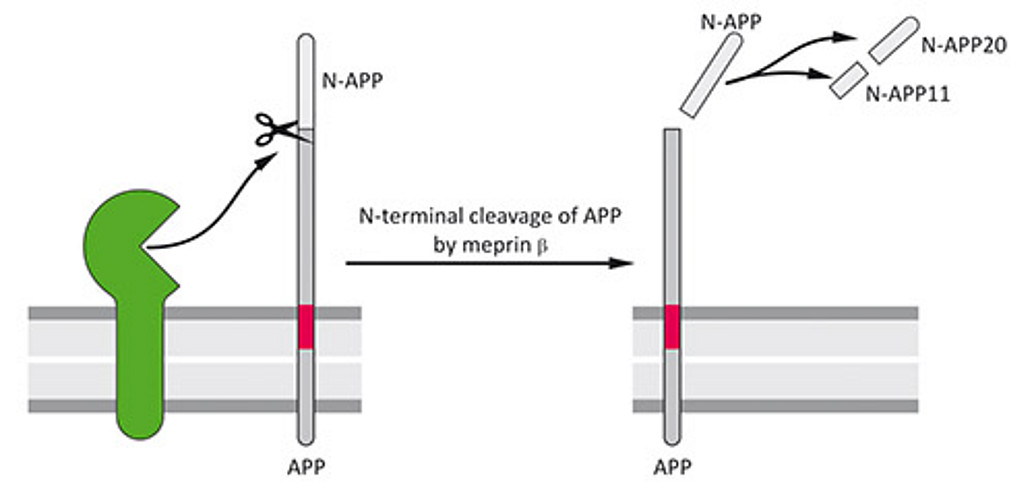
Um weiterhin die Rolle von Meprin β in der Pathogenese neurodegenrativer Erkrankungen wie Morbus Alzheimer aufzuklären, verwenden wir derzeit knock-out-, oder transgene Maus-Modelle sowie eine Reihe zellbiologischer Experimente.
2. Die molekulare und biochemische Funktion der Blut-Hirn-Schranke (BHS) im Verlauf der Alzheimer Krankheit.
Die Blut-Hirn-Schranke (BHS) spielt eine wesentliche Rolle bei der Aufrechterhaltung der Homöostase im Gehirn, indem sie die physiologische Barriere zwischen Blutkreislauf und Gehirn bildet. Hierdurch werden die Diffusion sowie das unkontrollierte Eindringen potentiell schädlicher Stoffe verhindert. Neuere Studien konnten unter anderem zeigen, dass die BHS auch eine Rolle bei der Pathogenese von Morbus Alzheimer spielt, indem der Transport des Amyloid β (Aβ) Peptides mit Hilfe des Low Density Lipoprotein Receptor-related Proteins 1 (LRP1) beeinflusst werden kann. Um den LRP1- vermittelten Aβ-Transport über die BHS weiterhin aufzuklären haben wir in unserer Gruppe ein in-vitro BHS-Transport-Modell mit primären Maushirn-Kapillarendothelzellen etabliert, welche funktional aktives LRP1 exprimieren. In diesen Zellen konnten wir mit Hilfe von transendothelialen Transportstudien zeigen, dass LRP1 die bidirektionale Transzytose von [125I]-Aβ1-40 über die BHS ermöglicht. Im Vergleich dazu wurde signifikant weniger Aβ in beide Richtungen transportiert, sobald das endogene LRP1-Gen eine inaktivierende knock-in Mutation im NPxYxxL Endozytose Motiv aufwies (Pflanzner et al. 2011, Neurobiology of Aging).
3. Die funktionale Rolle des Low-Density Lipoprotein Receptor-related Protein 1 (LRP1) im zentralen Nervensystem.
Das Low Density Lipoprotein Receptor-related Protein 1 (LRP1) gehört zur Familie der LDL-Rezeptoren und ist ein zellulärer Transmembranrezeptor, welcher eine Vielzahl unterschiedlicher Liganden binden und internalisieren kann. Neben seiner Rolle als Transportrezeptor scheint LRP1 auch an verschiedenen Signaltransduktionswegen beteiligt zu sein.
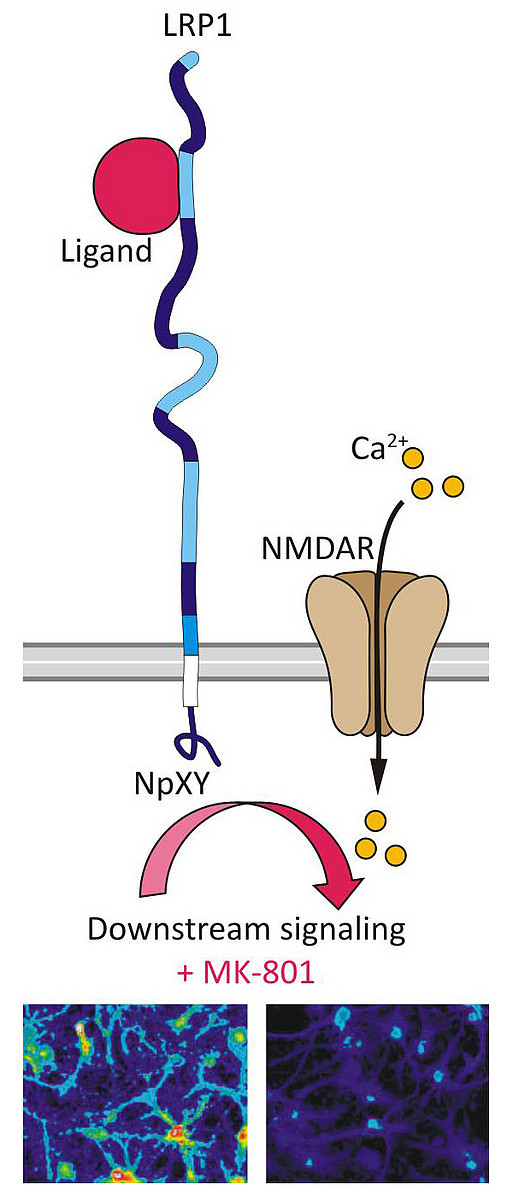
Unsere Gruppe konnte zeigen, dass LRP1 extrazelluläre Signale ins Zellinnere weiterleitet, wodurch N-methyl-D-Aspartat (NMDA) Rezeptor-abhängige MAP-Kinase Wege induzieren werden, welche an der Erk1/2-Phosphorylierung beteiligt sind (Martin et al. 2008, Journal of Biological Chemistry). Zurzeit untersuchen wir die funktionelle Kooperation von LRP1 mit dem NMDA Rezeptor mit Hilfe von LRP1 knock-in Mäusen, welche eine auf genetischer Ebene inaktivierte distale NPxY(2) Domäne am LRP1 C-Terminus aufweisen. Mit Hilfe von primären, hippokampalen Mausneuronen soll der Einfluss der inaktivierten NPXY2-Domäne auf die nachgeschalteten, NMDA-vermittelten Signalwege analysiert werden. Des Weiteren wollen wir aufklären, in wieweit Lipoproteinrezeptor Liganden die NMDA Rezeptor-Aktivität beeinflussen können. Anhand von Verhaltensanalysen konditionaler LRP1 knock-out oder knock-in Mäuse soll untersucht werden, in wie weit diese Liganden Einfluss auf das NMDA-vermittelte Lernverhalten nehmen können. Intrazelluläre Proteine können einerseits als Adapter fungieren oder dazu dienen, Signalkaskaden ins Zellinnere zu transferieren.
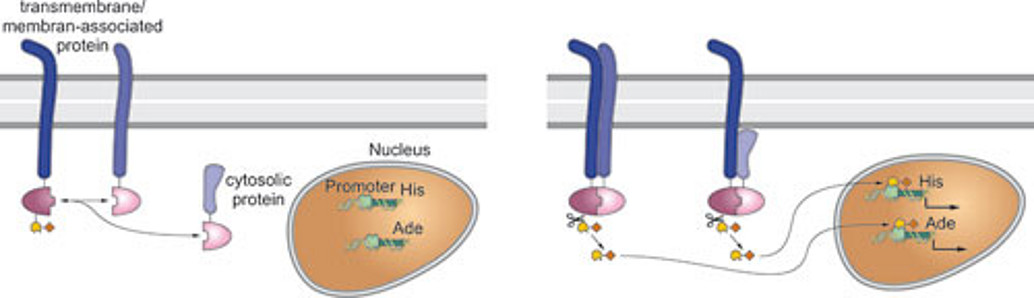
Daher liegt ein weiterer Schwerpunkt unserer Arbeit darauf, neue Interaktionspartner der Lipoproteinrezeptor-Familie mit Hilfe eines Hefe-basierenden Split-Ubiquitin-Systems zu identifizieren. Um weitere Einblicke in die physiologischen Funktionen verschiedener Lipoproteinrezeptoren zu erhalten, validieren wir derzeit potentielle Interaktionspartner mit Hilfe biochemischer sowie Zellkultur-basierender Experimente.
