Arbeitsgruppe Prof. Dr. Grabbe/PD Dr. Bros

Leitung:

Univ.-Prof. Dr. med. Stephan Grabbe
Direktor der Hautklinik und Poliklinik der Universitätsmedizin der Johannes Gutenberg-Universität Mainz KöR
Mitarbeiterinnen und Mitarbeiter:
Evelyn Montermann
Technische Angestellte
monterma@uni-mainz.de
Tel.: 06131-17-9852
Ingrid Tubbe
Technische Angestellte
tubbe@uni-mainz.de
Tel.: 06131-17-9852
Nadine Röhrig
Technische Angestellte
n.roehrig@uni-mainz.de
Tel. 06131-17-9758
Dr. Tanja Klaus
PostDoc
tklaus@students.uni-mainz.de
Tel. 06131-17-8793
Yanira Zeyn, M.Sc. Biomedizinische Chemie
Doktorandin
yanira.zeyn@uni-mainz.de
Tel.: 06131-17-9758
Christoph Hieber, M.Sc. Biomedizinische Chemie
Doktorand
chieber@uni-mainz.de
Tel.: 06131-17-9758
Vanessa Bolduan, M.Sc. Biomedizin
Doktorandin
vbolduan@students.uni-mainz.de
Tel.: 06131-17-9758
Laura Rosenberger, M.Sc. Biomedizinische Chemie
Doktorandin
lrosenbe@students.uni-mainz.de
Tel.: 06131-17-8793
Maike Hartmann, M.Sc. Molekulare Biowissenschaften
Doktorandin
hartmanm@uni-mainz.de
Tel.: 06131-17-8793
Atri Ghods, M.Sc. Immunologie
Doktorandin
atri.ghods@uni-mainz.de
Tel.: 06131-17-8793
Ort:
Gebäude-Nr. 308a (PKZI)EG, links
Tel: +49(0)6131-179758
Fax: +49(0)6131-179656
Ziele & Drittmittelgeförderte Projekte:
Nano-Impfstoffe für DC-fokussierte ImmuntherapienWir evaluieren Nano-Impfstoffe, die spezifisch an dendritische Zellen (DC) binden und nach ihrer Aufnahme Tumor-assoziierte Antigene sowie DC-aktivierende Substanzen abgeben sollen. Hierdurch können DC eine anti-Tumorantwort auslösen. In weiteren Studien wird versucht, neben DC auch toleranzinduzierende Immunzellen in der Leber so umzuprogrammieren, dass sie ebenfalls T-Zellen aktivieren. Dies ist insbesondere für eine Therapie von Leber-Metastasen relevant. Diese Projekte sind Teil des von der Deutschen Forschungsgemeinschaft (DFG) geförderten interdisziplinären Sonderforschungsbereichs 1066 (Projekte B04 und B15) und beinhalten eine enge Zusammenarbeit mit Laboren des Fachbereichs Chemie der JGU Mainz, des Max-Planck-Instituts für Polymerforschung (Mainz) und Forschern in Würzburg und Leiden (Niederlande).
ß2-Integrindefizienz in regulatorischen T-Zellen führt zu Autoimmunerkrankungen
Mäuse mit einer auf regulatorische T-Zellen (Treg) restringierten ß2-Integrindefizienz sind in ihrer immunregulatorischen Aktivität eingeschränkt. Daher weisen diese Mäuse altersabhängig zunehmend auto-inflammatorische Erkrankungen wie beispielsweise atopische Dermatitis auf. Unsere aktuellen Studien zielen darauf ab, die Bedeutung von b2-Integrinen für Treg-Funktionen auf zellulärer Ebene und in verschiedenen Autoimmunmodellen genauer zu verstehen. Dieses Projekt wird von der DFG im Rahmen des Transregio 156 (Projekt B11) gefördert und in Zusammenarbeit mit Laboren in Heidelberg und Tübingen durchgeführt.
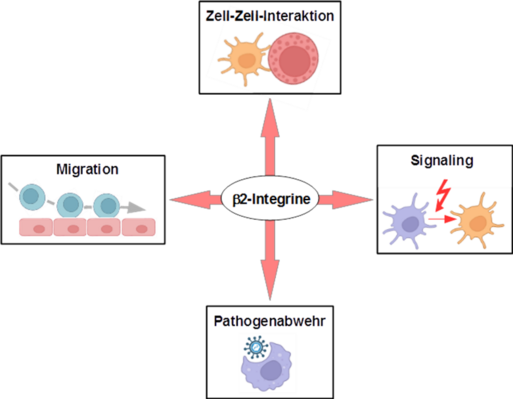
Relevanz von Treg für die Hauthomöostase
β2 Integrine sind für die ordnungsgemäße Zellfunktion in Leukozyten unerlässlich. Wir haben bereits gezeigt, dass Mäuse mit einer β2 Integrin-Defizienz keine T-Zellen in ihrer Haut haben und einen altersabhängigen Psoriasis-ähnlichen Phänotyp entwickeln. Dieses Projekt zielt darauf ab, die Bedeutung der Haut-residenten T-Zellen für die Gewebehomöostase und den Beitrag der bekanntermaßen altersabhängig differentiell regulierten β2 Integrine zur Immunoseneszenz von T-Zellen zu bestimmen. Diese Studie wird unser Verständnis der Mechanismen hinter altersbedingten Hauterkrankungen verbessern.
Bedeutung von β2 Integrinen für die Tumorigenese
Tumore entkommen einer Bekämpfung durch das Immunsystems u.a. durch die Reprogrammierung von Immun- und Stromazellen in ihrer unmittelbaren Umgebung. Diese Zellen bilden in ihrer Gesamtheit das sogenannte Tumor-Mikromilieu, das einerseits das Tumorwachstum z.B. durch die Freisetzung Blutgefäß-bildender Faktoren, fördert und andererseits die Effektorwirkung infiltrierender Immun-Effektorzellen inhibiert. Des Weiteren induzieren und expandieren Tumore regulatorische T-Zellen (Treg) und myeloide Suppressorzellen (MDSC), die die Aktivität antigenpräsentierender Zellen und die Aktivierbarkeit antigenspezifischer T-Zellen unterdrücken. Wir konnten zeigen, dass Mäuse mit einer zelltypspezifischen β2 Integrin-Defizienz in Treg bzw. MDSC gegenüber einer Tumorinduktion partiell geschützt sind und diejenigen Mäuse, die Tumore entwickeln, ein im Vergleich zu Kontrolltieren ein deutlich reduziertes Tumorwachstum aufweisen. Derzeit untersuchen wir die hierfür zugrunde liegenden zellulären und molekularen Ursachen, auch im Hinblick auf mögliche Therapieansätze.
β2 Integrine sind für die ordnungsgemäße Zellfunktion in Leukozyten unerlässlich. Wir haben bereits gezeigt, dass Mäuse mit einer β2 Integrin-Defizienz keine T-Zellen in ihrer Haut haben und einen altersabhängigen Psoriasis-ähnlichen Phänotyp entwickeln. Dieses Projekt zielt darauf ab, die Bedeutung der Haut-residenten T-Zellen für die Gewebehomöostase und den Beitrag der bekanntermaßen altersabhängig differentiell regulierten β2 Integrine zur Immunoseneszenz von T-Zellen zu bestimmen. Diese Studie wird unser Verständnis der Mechanismen hinter altersbedingten Hauterkrankungen verbessern.
Bedeutung von β2 Integrinen für die Tumorigenese
Tumore entkommen einer Bekämpfung durch das Immunsystems u.a. durch die Reprogrammierung von Immun- und Stromazellen in ihrer unmittelbaren Umgebung. Diese Zellen bilden in ihrer Gesamtheit das sogenannte Tumor-Mikromilieu, das einerseits das Tumorwachstum z.B. durch die Freisetzung Blutgefäß-bildender Faktoren, fördert und andererseits die Effektorwirkung infiltrierender Immun-Effektorzellen inhibiert. Des Weiteren induzieren und expandieren Tumore regulatorische T-Zellen (Treg) und myeloide Suppressorzellen (MDSC), die die Aktivität antigenpräsentierender Zellen und die Aktivierbarkeit antigenspezifischer T-Zellen unterdrücken. Wir konnten zeigen, dass Mäuse mit einer zelltypspezifischen β2 Integrin-Defizienz in Treg bzw. MDSC gegenüber einer Tumorinduktion partiell geschützt sind und diejenigen Mäuse, die Tumore entwickeln, ein im Vergleich zu Kontrolltieren ein deutlich reduziertes Tumorwachstum aufweisen. Derzeit untersuchen wir die hierfür zugrunde liegenden zellulären und molekularen Ursachen, auch im Hinblick auf mögliche Therapieansätze.
Drittmittelgeförderte Projekte:
- SFB1066:
B04: Polymer-vermittelte Tumor-Immuntherapie durch in situ Aktivierung von antigenpräsentierenden Zellen
B15: Induktion intrahepatischer anti-Tumor-Immunität durch Adressierung dendritischer Zellen und Reprogrammierung protolerogener non-parenchymaler Zellpopulationen - TRR156:
B11: The role of CD18 and regulatory T cells in skin inflammation - SHARP:
Project 9: Die Bedeutung haut-residenter Lymphozyten für die Gewebs-Homöostase und periphere Toleranz in alternder Haut - DFG-Einzelprojekt: Beeinflussung von Immunantworten durch KSRP
Ausgewählte Publikationen:
Heck AG, Stickdorn J, Rosenberger LJ, Scherger M, Woller J, Eigen K, Bros M, Grabbe S, Nuhn L. Polymerizable 2-Propionic-3-methylmaleic Anhydrides as a Macromolecular Carrier Platform for pH-Responsive Immunodrug Delivery. J Am Chem Soc. 2023 Dec 20;145(50):27424-27436. doi: 10.1021/jacs.3c08511.Hieber C, Grabbe S, Bros M. Counteracting Immunosenescence-Which Therapeutic Strategies Are Promising? Biomolecules. 2023 Jul 6;13(7):1085. doi:10.3390/biom13071085.
Haist M, Stege H, Kuske M, Bauer J, Klumpp A, Grabbe S, Bros M. Combination of immune-checkpoint inhibitors and targeted therapies for melanoma therapy: The
more, the better? Cancer Metastasis Rev. 2023 Jun;42(2):481-505. doi:
10.1007/s10555-023-10097-z.
Klaus T, Wilson A, Fichter M, Bros M, Bopp T, Grabbe S. The Role of LFA-1 for the Differentiation and Function of Regulatory T Cells-Lessons Learned from Different Transgenic Mouse Models. Int J Mol Sci. 2023 Mar 28;24(7):6331. doi:10.3390/ijms24076331.
Klaus T, Wilson AS, Vicari E, Hadaschik E, Klein M, Helbich SSC, Kamenjarin N, Hodapp K, Schunke J, Haist M, Butsch F, Probst HC, Enk AH, Mahnke K, Waisman A, Bednarczyk M, Bros M, Bopp T, Grabbe S. Impaired Treg-DC interactions contribute to autoimmunity in leukocyte adhesion deficiency type 1. JCI Insight. 2022 Dec 22;7(24):e162580. doi: 10.1172/jci.insight.162580.
Sohl J, Hartmann AK, Hahlbrock J, Bartneck J, Stassen M, Klein M, Bros M, Grabbe S, Marini F, Woods K, Guezguez B, Mack M, Schild H, Muth S, Melchior F, Probst HC, Langguth P, Radsak MP. Dithranol as novel co-adjuvant for non-invasive dermal vaccination. NPJ Vaccines. 2022 Sep 24;7(1):112. doi:10.1038/s41541-022-00530-9.
Bednarczyk M, Bolduan V, Haist M, Stege H, Hieber C, Johann L, Schelmbauer C, Blanfeld M, Karram K, Schunke J, Klaus T, Tubbe I, Montermann E, Röhrig N, Hartmann M, Schlosser J, Bopp T, Clausen BE, Waisman A, Bros M, Grabbe S. β2 Integrins on Dendritic Cells Modulate Cytokine Signaling and Inflammation-Associated Gene Expression, and Are Required for Induction of Autoimmune Encephalomyelitis. Cells. 2022 Jul 13;11(14):2188. doi: 10.3390/cells11142188.
Medina-Montano C, Cacicedo ML, Svensson M, Limeres MJ, Zeyn Y, Chaves-Giraldo JE, Röhrig N, Grabbe S, Gehring S, Bros M. Enrichment Methods for Murine Liver Non-Parenchymal Cells Differentially Affect Their Immunophenotype and Responsiveness towards Stimulation. Int J Mol Sci. 2022 Jun 11;23(12):6543. doi:10.3390/ijms23126543.
Haist M, Ries F, Gunzer M, Bednarczyk M, Siegel E, Kuske M, Grabbe S, Radsak M, Bros M, Teschner D. Neutrophil-Specific Knockdown of β2 Integrins Impairs Antifungal Effector Functions and Aggravates the Course of Invasive Pulmonal Aspergillosis. Front Immunol. 2022 Jun 6;13:823121. doi:10.3389/fimmu.2022.823121.
Czysch C, Medina-Montano C, Dal NK, Dinh T, Fröder Y, Winterwerber P, Maxeiner K, Räder HJ, Schuppan D, Schild H, Bros M, Biersack B, Feranoli F, Grabbe S, Nuhn L. End Group Dye-Labeled Polycarbonate Block Copolymers for Micellar (Immuno-)Drug Delivery. Macromol Rapid Commun. 2022 Jun;43(12):e2200095. doi: 10.1002/marc.202200095.
Zeyn Y, Harms G, Tubbe I, Montermann E, Röhrig N, Hartmann M, Grabbe S, Bros M. Inhibitors of the Actin-Bundling Protein Fascin-1 Developed for Tumor Therapy Attenuate the T-Cell Stimulatory Properties of Dendritic Cells. Cancers (Basel). 2022 May 31;14(11):2738. doi: 10.3390/cancers14112738.
Kuske M, Haist M, Jung T, Grabbe S, Bros M. Immunomodulatory Properties ofImmune Checkpoint Inhibitors-More than Boosting T-Cell Responses? Cancers (Basel). 2022 Mar 28;14(7):1710. doi: 10.3390/cancers14071710.
Stickdorn J, Stein L, Arnold-Schild D, Hahlbrock J, Medina-Montano C, Bartneck J, Ziß T, Montermann E, Kappel C, Hobernik D, Haist M, Yurugi H, Raabe M, Best A, Rajalingam K, Radsak MP, David SA, Koynov K, Bros M, Grabbe S, Schild H, Nuhn L. Systemically Administered TLR7/8 Agonist and Antigen-Conjugated Nanogels Govern Immune Responses against Tumors. ACS Nano. 2022 Mar 22;16(3):4426-4443. doi: 10.1021/acsnano.1c10709.
Jung T, Haist M, Kuske M, Grabbe S, Bros M. Immunomodulatory Properties of BRAF and MEK Inhibitors Used for Melanoma Therapy-Paradoxical ERK Activation and Beyond. Int J Mol Sci. 2021 Sep 13;22(18):9890. doi: 10.3390/ijms22189890.
Kappel C, Seidl C, Medina-Montano C, Schinnerer M, Alberg I, Leps C, Sohl J, Hartmann AK, Fichter M, Kuske M, Schunke J, Kuhn G, Tubbe I, Paßlick D, Hobernik D, Bent R, Haas K, Montermann E, Walzer K, Diken M, Schmidt M, Zentel R, Nuhn L, Schild H, Tenzer S, Mailänder V, Barz M, Bros M, Grabbe S. Density of Conjugated Antibody Determines the Extent of Fc Receptor Dependent Capture of Nanoparticles by Liver Sinusoidal Endothelial Cells. ACS Nano. 2021 Sep 28;15(9):15191-15209. doi: 10.1021/acsnano.1c05713. Epub 2021 Aug 25.
Bednarczyk M, Medina-Montano C, Fittler FJ, Stege H, Roskamp M, Kuske M, Langer C, Vahldieck M, Montermann E, Tubbe I, Röhrig N, Dzionek A, Grabbe S, Bros M. Complement-Opsonized Nano-Carriers Are Bound by Dendritic Cells (DC) via Complement Receptor (CR)3, and by B Cell Subpopulations via CR-1/2, and Affect the Activation of DC and B-1 Cells. Int J Mol Sci. 2021 Mar 11;22(6):2869. doi:10.3390/ijms22062869.
Haist M, Stege H, Grabbe S, Bros M. The Functional Crosstalk between Myeloid-Derived Suppressor Cells and Regulatory T Cells within the Immunosuppressive Tumor Microenvironment. Cancers (Basel). 2021 Jan 8;13(2):210. doi:10.3390/cancers13020210.
Bednarczyk M, Stege H, Grabbe S, Bros M. β2 Integrins-Multi-Functional Leukocyte Receptors in Health and Disease. Int J Mol Sci. 2020 Feb 19;21(4):1402. doi: 10.3390/ijms21041402.
Bros M, Haas K, Moll L, Grabbe S. RhoA as a Key Regulator of Innate and Adaptive Immunity. Cells. 2019 Jul 17;8(7):733. doi: 10.3390/cells8070733.
Teschner D, Cholaszczyńska A, Ries F, Beckert H, Theobald M, Grabbe S, Radsak M, Bros M. CD11b Regulates Fungal Outgrowth but Not Neutrophil Recruitment in a Mouse Model of Invasive Pulmonary Aspergillosis. Front Immunol. 2019 Feb 4;10:123. doi: 10.3389/fimmu.2019.00123.
Sahin U, Oehm P, Derhovanessian E, Jabulowsky RA, Vormehr M, Gold M, Maurus D, Schwarck-Kokarakis D, Kuhn AN, Omokoko T, Kranz LM, Diken M, Kreiter S, Haas H, Attig S, Rae R, Cuk K, Kemmer-Brück A, Breitkreuz A, Tolliver C, Caspar J, Quinkhardt J, Hebich L, Stein M, Hohberger A, Vogler I, Liebig I, Renken S, Sikorski J, Leierer M, Müller V, Mitzel-Rink H, Miederer M, Huber C, Grabbe S, Utikal J, Pinter A, Kaufmann R, Hassel JC, Loquai C, Türeci Ö. An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma. Nature. 2020 Sep;585(7823):107-112. doi: 10.1038/s41586-020-2537-9.
Sahin U, Derhovanessian E, Miller M, Kloke BP, Simon P, Löwer M, Bukur V, Tadmor AD, Luxemburger U, Schrörs B, Omokoko T, Vormehr M, Albrecht C, Paruzynski A, Kuhn AN, Buck J, Heesch S, Schreeb KH, Müller F, Ortseifer I, Vogler I, Godehardt E, Attig S, Rae R, Breitkreuz A, Tolliver C, Suchan M, Martic G, Hohberger A, Sorn P, Diekmann J, Ciesla J, Waksmann O, Brück AK, Witt M, Zillgen M, Rothermel A, Kasemann B, Langer D, Bolte S, Diken M, Kreiter S, Nemecek R, Gebhardt C, Grabbe S, Höller C, Utikal J, Huber C, Loquai C, Türeci Ö. Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature. 2017 Jul 13;547(7662):222-226. doi: 10.1038/nature23003.
