Mukosale Mikrobiologie und Immunologie (Vieira-Silva Labor)
Aktuelle Forschung
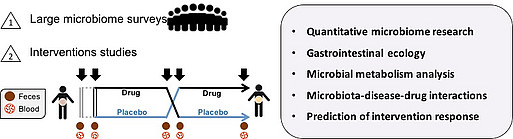
Das Vieira-Silva-Labor erforscht die Ökologie wirtsassoziierter mikrobieller Gemeinschaften, wobei der Schwerpunkt auf dem menschlichen Magen-Darm-Trakt liegt. Unsere Forschung konzentriert sich auf das Verständnis der ökologischen Dynamik menschlicher Darm-assoziierter mikrobieller Gemeinschaften in einer gesunden Wirts-Mikrobiom-Homöostase und darauf, wie ihre Störung zum Risiko des Auftretens oder Fortschreitens von Krankheiten beiträgt. Wir wenden quantitative Ansätze auf Populationskohortenstudien und Interventionsstudien an, um die Mechanismen zu ermitteln, die die Dynamik des gesunden Darmökosystems antreiben, die Faktoren, die seine Widerstandsfähigkeit gegenüber Störungen bestimmen, und die Veränderungen, die zu Krankheiten beitragen (Dysbiose).
Unsere Forschung zielt darauf ab, die Mechanismen zu entschlüsseln, die die Widerstandsfähigkeit der Mikrobiota bestimmen oder andererseits zu einem erhöhten Risiko der Krankheitsentwicklung beitragen. Wir konzentrieren uns auch auf die Verfolgung der metabolischen Kapazität der Darmmikrobiota und ihrer symbiotischen oder schädlichen Verbindung mit dem Wirt, auch durch bidirektionale Interaktionen mit dem Immunsystem. Unsere Ziele sind die Identifizierung und Quantifizierung des Beitrags des Darmmikrobioms zum Risiko der Krankheitsentwicklung und die Entwicklung von Mikrobiota-Sanierungsstrategien für (kombinierte) therapeutische Interventionen. Zu diesem Zweck bevorzugen wir ein hypothesengesteuertes experimentelles Design und investieren in die Entwicklung experimenteller und computergestützter Ansätze zur Untersuchung humanassoziierter mikrobieller Gemeinschaften. Insbesondere investieren wir in die kontinuierliche Entwicklung von bioinformatischen Werkzeugen, um interpretierbare Merkmale aus metagenomischen Daten zu extrahieren, sowie in rechnerische Ansätze zur Quantifizierung der ökologischen Dynamik und der Wirt-Mikrobiom-Interaktionen. Parallel dazu entwickeln wir neue experimentelle Ansätze, um qualitativ hochwertige und hochauflösende quantitative Multi-omics- und klinische Daten zu erhalten (insbesondere quantitative Mikrobiomprofile auf Stammebene, die auf der Parallelisierung von Mikrobiom-Sequenzierung und der Quantifizierung der gesamten mikrobiellen Dichte durch Durchflusszytometrie basieren).
Forschungsschwerpunkt #1 - Ökologische Dynamik und Widerstandsfähigkeit der menschlichen Darmmikrobiota
Die Darmmikrobiota weist eine hohe Variabilität auf, selbst in Querschnitten gesunder menschlicher Populationen. Unsere Forschung zielt darauf ab, die Grenzen der Variation der Darmmikrobiota bei gesunden Menschen zu definieren und Wirts- und Lebensstilkovariaten zu entflechten, die die Zusammensetzung und das metabolische Potenzial der Darmmikrobiota beeinflussen, ohne notwendigerweise Krankheiten zu verursachen. Wir nutzen prospektive Studien auf Bevölkerungsebene wie die Gutenberg-Gesundheitsstudie (GHS, n=15.000, Mainz, Deutschland), die sowohl das Mikrobiom als auch eine umfassende klinische Überwachung eines durchschnittlichen Teils der Bevölkerung einschließen, um normale Variationen des Ökosystems (Eubiose) zu charakterisieren, was ein notwendiger Schritt zur Untersuchung abweichender Mikrobiota-Zustände (Dysbiose) ist.
Mithilfe der quantitativen metagenomischen Profilerstellung der Mikrobiota-Zusammensetzung können wir Wirts- und Lebensstilkovariaten entschlüsseln, die die Zusammensetzung und das metabolische Potenzial von Darmgemeinschaften beeinflussen, ohne die Gesundheit zu beeinträchtigen.
Forschungsschwerpunkt #2 - Resilienz des Mikrobioms beim gesunden Altern
Eine Störung des Mikrobioms oder die Entwicklung einer Dysbiose gilt als eines der Kennzeichen des Alterns. Nach der Erstbesiedlung des Darmhabitats im Säuglingsalter stabilisiert sich die Darmmikrobiota gesunder Menschen und schwankt zwischen einer begrenzten Anzahl reifer, eubiotischer Konfigurationen. Mit zunehmendem Alter neigt die Mikrobiota zu einer stetigen Diversifizierung, wobei der menschliche Wirt durch Ernährung, soziale Interaktionen und Umwelteinflüsse allmählich eine größere Anzahl von Kolonisatoren erwirbt. Am anderen Ende des Gesundheitsspektrums wird das Altern auch mit einer erhöhten Prävalenz der Dysbiose in Verbindung gebracht, die durch einen abrupten Verlust der mikrobiellen Vielfalt und einen dramatischen Rückgang der Häufigkeit von Schlüsselarten gekennzeichnet ist. Die Entwicklung einer Dysbiose kann mit der Anfälligkeit für Krankheiten, einem ausgeprägteren systemischen Entzündungstonus und, speziell bei älteren Menschen, mit Gebrechlichkeit und Immunoseneszenz in Verbindung gebracht werden. Durch die Bewertung der Mikrobiom-Variationen in Bevölkerungskohorten über eine Reihe von Altersgruppen hinweg wollen wir gesundheits- und lebensstilbedingte Umwelt- und mikrobiom-immanente Faktoren für die Stabilität und Widerstandsfähigkeit des Darmökosystems beim gesunden Altern entschlüsseln. Dies wiederum ist ein wertvoller Schritt zur Entwicklung neuartiger Strategien zur Modulation der Mikrobiota, um die Entwicklung einer altersbedingten Dysbiose zu verhindern oder ihr entgegenzuwirken.
Forschungsschwerpunkt #3 - Wechselwirkungen zwischen Wirt, Mikrobiom und Medikamenten bei Krankheiten
Sowohl akademische Institute als auch pharmazeutische Unternehmen führen derzeit Arzneimittelinterventionsstudien mit Mikrobiota-Monitoring durch, um zu untersuchen, wie sich die Zusammensetzung der Mikrobiota auf das Ansprechen auf eine Behandlung auswirkt, oder um Arzneimittel zu identifizieren, die das Potenzial haben, für eine Wiederherstellung der Mikrobiota eingesetzt zu werden. Im Rahmen des BMBF-Exzellenzclusters CurATime erforscht das Vieira-Silva-Labor den Beitrag des Darmmikrobioms zum Risiko kardiovaskulärer Erkrankungen und der Entwicklung einer Atherothrombose mit zunehmendem Alter in Kohorten, die bereits umfassend klinisch phänotypisiert wurden. Unser Ziel ist es, geschlechtsspezifische Mikrobiom-Signaturen zu identifizieren, die dabei helfen, Patienten für eine bessere Medikamentenzuteilung zu stratifizieren und frühe Risikomarker für das Fortschreiten der Krankheit oder den Ausgang zu definieren, und die langfristig zur Entwicklung neuer therapeutischer Ansätze bei Herz-Kreislauf-Erkrankungen beitragen.
Forschungsschwerpunkt #4 - Mechanistische Modellierung von Wirt-Mikrobiota-Interaktionen
Mechanistische Modelle ermöglichen es uns, mechanistische Erkenntnisse zu testen und zu gewinnen und neue Hypothesen zu entwickeln. Die Mikrobiomforschung selbst hat sich weiterentwickelt, um quantitative, reproduzierbare und höher aufgelöste Daten zu generieren, die es ermöglichen, Modellierungsansätze anzuwenden. Unser Ziel ist es, in den Aufbau interpretierbarer mechanistischer Modelle von Wirt-Mikrobiom-Interaktionen zu investieren, um Mikrobiota-Wirt- und Mikrobe-Mikroben-Interaktionen von klinischer Bedeutung zu entschlüsseln. Wir konzentrieren uns insbesondere auf Wechselwirkungen zwischen Mikrobiota und Immunsystem, die mit dem Fortschreiten von Stoffwechsel- und Herz-Kreislauf-Erkrankungen in Zusammenhang stehen.
Bewerbung
Doktoranden und Postdocs: Wir fördern ein vielfältiges Umfeld, um gemeinsame interdisziplinäre Forschungsprojekte zu unterstützen. Wenn Sie an einer Zusammenarbeit mit uns interessiert sind, senden Sie bitte eine Anfrage an sara.vieira-silva@uni-mainz.de mit dem Betreff "[PhD or Postdoc] position at Vieira-Silva Lab". Bitte fügen Sie einen Lebenslauf und ein kurzes Motivationsschreiben bei, in dem Sie Ihre bisherigen Erfahrungen und Forschungsinteressen darlegen und erläutern, warum Sie mit uns zusammenarbeiten möchten.Mitarbeiter

Bharat Joshi
Doktorand

Laura Peschke
Doktorandin
Ausgewählte Publikationen
2023Fan Y, Støving RK, Berreira Ibraim S, Hyötyläinen T, Thirion F, Arora T, Lyu L, Stankevic E, Hansen TH, Déchelotte P, Sinioja T, Ragnarsdottir O, Pons N, Galleron N, Quinquis B, Levenez F, Roume H, Falony G, Vieira-Silva S, Raes J, Clausen L, Telléus GK, Bäckhed F, Oresic M, Ehrlich SD, Pedersen O. 2023. The gut microbiota contributes to the pathogenesis of anorexia nervosa in humans and mice. Nat Microbiol. May;8(5):787-802.
Suriano F, Vieira-Silva S, Falony G, de Wouters d’Oplinter A, Paone P, Delzenne NM, Everard A, Raes J, Van Hul M, Cani PD. 2023. Fat and not sugar as the determining factor for gut microbiota changes, obesity, and related metabolic disorders in mice. Am J Physiol Endocrinol Metab 324:E85–E96.
Devolder L, Pauwels A, Van Remoortel A, Falony G, Vieira-Silva S, Nagels G, De Keyser J, Raes J, D’Hooghe MB. 2023. Gut microbiome composition is associated with long-term disability worsening in multiple sclerosis. Gut Microbes 15:2180316.
2022
Valles-Colomer M*, Bacigalupe R*, Vieira-Silva S*, Suzuki S, Darzi Y, Tito RY, Yamada T, Segata N, Raes J*, Falony G*. 2022. Variation and transmission of the human gut microbiota across multiple familial generations. Nat Microbiol, 7:87–96.
2021
Lloréns-Rico V, Vieira-Silva S, Gonçalves PJ, Falony G*, Raes J*. 2021. Benchmarking microbiome transformations favors experimental quantitative approaches to address compositionality and sampling depth biases. Nat Commun, 12
Brial F*, Chilloux J*, Nielsen T*, Vieira-Silva S*, Falony G, Andrikopoulos P, Olanipekun M, Hoyles L, Djouadi F, Neves AL, Rodriguez-Martinez A, Mouawad GI, Pons N, Forslund S, Le-Chatelier E, Le Lay A, Nicholson J, Hansen T, Hyötyläinen T, Clément K, Oresic M, Bork P, Ehrlich SD, Raes J, Pedersen OB, Gauguier D, Dumas ME. 2021. Human and preclinical studies of the host-gut microbiome co-metabolite hippurate as a marker and mediator of metabolic health. Gut, 70:2105–2114
2020
Vieira-Silva S*, Falony G*, Belda E*, Nielsen T, Aron-Wisnewsky J, Chakaroun R, Forslund SK, Assmann K, Valles-Colomer M, [MetaCardis Consortium: 90 authors], Stumvoll M, Vestergaard H, Zucker JD, Bork P, Pedersen O, Bäckhed F, Clément K, Raes J. 2020. Statin therapy is associated with lower prevalence of gut microbiota dysbiosis. Nature, 581: 310–315
2019
Vieira-Silva S*, Sabino J*, Valles-Colomer M*, Falony G*, Kathagen G, Caenepeel C, Cleynen I, Van der Merwe S, Vermeire S* and Raes J*. 2019. Quantitative microbiome profiling disentangles inflammation- and bile duct obstruction-associated microbiota alterations across IBD/PSC diagnoses. Nat Microbiol, 4:1826–1831
Valles-Colomer M*, Falony G*, Darzi Y, Tigchelaar EF, Wang J, Tito RY, Schiweck C, Kurilshikov A, Joossens M, Wijmenga C, Claes S, Van Oudenhove L, Zhernakova A, Vieira-Silva S* and Raes J*. 2019. The neuroactive potential of the human gut microbiota in quality of life and depression. Nat Microbiol, 4:623–632
2018
Falony G, Vieira-Silva S & Raes J. 2018. Richness and ecosystem development across faecal snapshots of the gut microbiota. Nat Microbiol 3, 526–528
2017
Vandeputte D*, Kathagen G*, D’hoe K*, Vieira-Silva S*, Valles-Colomer M, Sabino J, Wang J, Tito RY, De Commer L, Darzi Y, Vermeire S, Falony G* and Raes J*. 2017. Quantitative microbiome profiling links gut community variation to microbial load. Nature, 551:507–511
2016
Vieira-Silva S*, Falony G*, Darzi Y, Lima-Mendez G, Garcia Yunta R, Okuda S, Vandeputte D, Valles-Colomer M, Hildebrand F, Chaffron S & Raes J. 2016. Species-function relationships shape ecological properties of the human gut microbiome. Nat Microbiol 1, 16088
Falony G*, Joossens M*, Vieira-Silva S*, Wang J*, Darzi Y, Faust K, Kurilshikov A, Bonder MJ, Valles-Colomer M, Vandeputte D, Tito RY, Chaffron S, Rymenans L, Verspecht C, De Sutter L, Lima-Mendez G, D’hoe K, Jonckheere K, et al. 2016. Population-level analysis of gut microbiome variation. Science 352, 560–4
