Systemmedizin
Pathophysiologie von Erkrankungen auf molekularer Ebene verstehen
Die Klinische Epidemiologie und Systemmedizin (CESM) nutzt eine Kombination aus Methoden der modernen Systemmedizin und der klinischen Epidemiologie, um ein neues Verständnis von komplexen Erkrankungen zu erhalten. Dazu werden vielfältige Datenebenen – von DNA über das Transkriptom, das Proteom und Metabolom, sowie regulatorische Ebenen einschließlich DNA-Methylierung – holistisch und integriert in detaillierte klinische Phänotyp-Daten ausgewertet. Somit wird eine reale Abbildung der untersuchten Erkrankung im Kontext des jeweiligen biologischen Systems möglich. Das Ziel des transdisziplinären Expert:innenteams ist zu verstehen, ob und wie diese Prozesse ursächlich mit der Erkrankung zusammenhängen.Sequentielle Multi-Omics-Daten
Die Gutenberg-Kohorten der CESM (z.B. Gutenberg-Gesundheitsstudie, Gutenberg COVID-19 Studie, MyoVasc) zeichnen sich dadurch aus, dass Bioproben sequentiell zu mehreren Zeitpunkten gewonnen werden. An den Bioproben wird ein Multi-omics-Profiling durchgeführt und die Nachbearbeitung erfolgt nach hoch standardisierten Verfahren. Dies ermöglicht einen hochauflösenden Einblick in die Pathophysiologie der Erkrankung in allen Stadien - von der Phase vor Erkrankungsbeginn bis zur akuten Erkrankung, ihrem Verlauf und ihrem Ausgang.Fortschrittliche Analysemethoden zur Generierung von Wissen
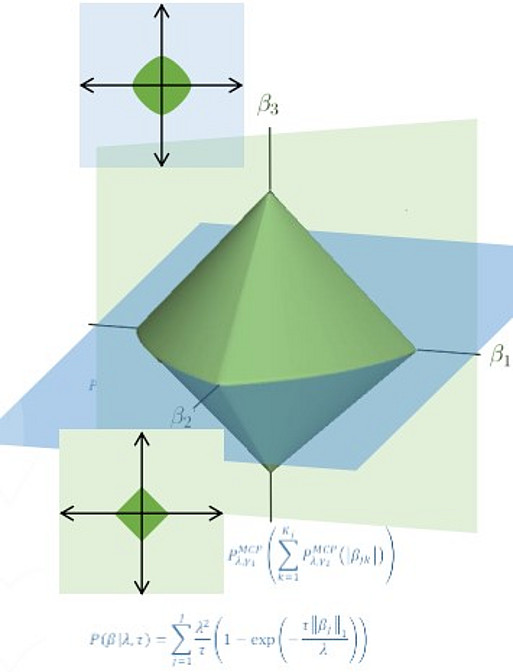
Zur Unterstützung innovativer systemmedizinischer Forschung beschäftigt die CESM Statistiker:innen und Forscher:innen, die sich der Entwicklung neuer biostatistischer und maschineller Lernmethoden widmen. Diese Methoden werden für den spezifischen Zweck jeder Untersuchung optimiert, sei es die Entdeckung von Wirkstoffzielen, die mechanistische Erforschung der Beteiligung von Pathways, die Überwachung der Krankheitsentwicklung im Laufe der Zeit oder integrative Multi-omics-Ansätze, die auch weniger gut charakterisierte Datenebenen wie das Lipidom umfassen.
Bei allen Anwendungen ist es wichtig, dass Schlüsselmerkmale des zu untersuchenden biologischen Systems angemessen erfasst werden, z.B. nicht-lineare Beziehungen, Wechselwirkungen und gruppierende Strukturen (z. B. auf der Grundlage gemeinsamer Pathways, Funktionen oder Sequenzhomologie). Um diesen Anforderungen in extrem hochdimensionalen Umgebungen gerecht zu werden, werden ständig neue Methoden entwickelt und implementiert.
Bei allen Anwendungen ist es wichtig, dass Schlüsselmerkmale des zu untersuchenden biologischen Systems angemessen erfasst werden, z.B. nicht-lineare Beziehungen, Wechselwirkungen und gruppierende Strukturen (z. B. auf der Grundlage gemeinsamer Pathways, Funktionen oder Sequenzhomologie). Um diesen Anforderungen in extrem hochdimensionalen Umgebungen gerecht zu werden, werden ständig neue Methoden entwickelt und implementiert.
Deep Learning für verbesserte Merkmalsextraktion aus klinischer Bildgebung

In Kliniken wird täglich eine große Menge an klinischen Bildgebungsdaten erzeugt. Trotz der jüngsten Fortschritte wird derzeit nur ein Bruchteil dieser Daten für klinische oder Forschungsanwendungen genutzt. Neue Entwicklungen bei der Künstlichen Intelligenz (KI), insbesondere im Teilbereich des Deep Learning, eröffnen die Möglichkeit, das große Potenzial dieser bislang ungenutzten Ressource zu heben. CESM-Forscher:innen und –Mitarbeiter:innen arbeiten gemeinsam an der Optimierung von Deep-Learning-Architekturen zur Automatisierung und Verbesserung klinischer Bildgebungspipelines sowie an der Extraktion neuartiger Merkmale, die die individualisierte Risikovorhersage verbessern und beschleunigen könnten.
