AG Immunpathologie
Arbeitsgruppenleitung:

Univ.-Prof. Dr.med. Matthias Gaida
Arzt
E‐Mail: Matthias.Gaida@unimedizin-mainz.de
Telefon: +49 (0) 6131 17-3269
Arbeitsgruppenmitglieder:
Nina Tagscherer (Doktorandin Joint Unit)
Juna Li (Medizinstudentin, Doktorarbeit)
Melina Becker (Masterstudentin, Masterarbeit)
Annika Wagner (Masterstudentin, Masterarbeit)
Ehemalige Mitglieder der Arbeitsgruppe:
Dr. med. Dr. med. dent. Lukas Olk (Arzt)
Dr. med. Louisa Stern (Doktorandin)
Dr. rer. nat. Alica Linnebacher (Doktorandin)
Sophia Gittermann (Medizinstudentin, Doktorarbeit)
Artun Bülbül (Doktorand)
Anja Bahn (Masterstudentin, Masterarbeit)
Siri Kröncke (Bachelorstudentin, Bachelorarbeit)

Forschungsschwerpunkt:
Wir bieten ständig individuell zugeschnittene Projekte für Dissertationen in den Bereichen Medizin und Biologie sowie für Bachelor- und Masterarbeiten an.
Verschaffen Sie sich einen Überblick über die aktuellen Forschungsprojekte der Arbeitsgruppe, lernen Sie uns im persönlichen Gespräch kennen und werden Sie Teil des interdisziplinären Forschungsteams aus Biologinnen und Biologen sowie Medizinerinnen und Medizinern. Haben wir Ihr Interesse geweckt? Dann nehmen Sie gerne Kontakt mit uns auf Matthias.Gaida@unimedizin-mainz.de.
Eine aktuelle Übersicht über die derzeit laufenden Forschungsprojekte finden Sie hier:
Das duktale Adenokarzinom des Pankreas (PDAC) ist eine der aggressivsten Krebsarten mit einer 5-Jahres-Überlebensrate von weniger als 10 %. Nach jüngsten Prognosen wird das PDAC im Jahr 2030 voraussichtlich die zweithäufigste Ursache für krebsbedingte Todesfälle sein. Ein PDAC wird in der Regel erst in fortgeschrittenen Stadien diagnostiziert, hat nur wenige Behandlungsmöglichkeiten und spricht schlecht auf die derzeit verfügbaren (Radio-) Chemotherapien an, so dass eine kurative Operation nur für etwa 20 % der Patienten in Frage kommt. Daher besteht ein dringender Bedarf an neuartigen Therapien.
Forschungsprojekte:
Ein wichtiger Grund für den begrenzten chirurgischen Therapieerfolg und die hohe Rezidivrate beim PDAC ist die tumoröse Infiltration des peripankreatischen Fettgewebes, die bei der überwiegenden Mehrzahl der Patienten mit der Diagnose PDAC zu finden ist. An der Grenzfläche zwischen Tumor und Fettgewebe, dem so genannten Invasionsrand, kann es zu einer Interaktion zwischen Tumorzellen und Adipozyten kommen. Es ist bekannt, dass Adipozyten die Tumorprogression unter anderem durch die Sekretion verschiedener Faktoren fördern können.
Unser Ziel ist es, diese lokale Interaktion zwischen Adipozyten und Tumorzellen im Tumormikromilieu beim PDAC genauer zu untersuchen.
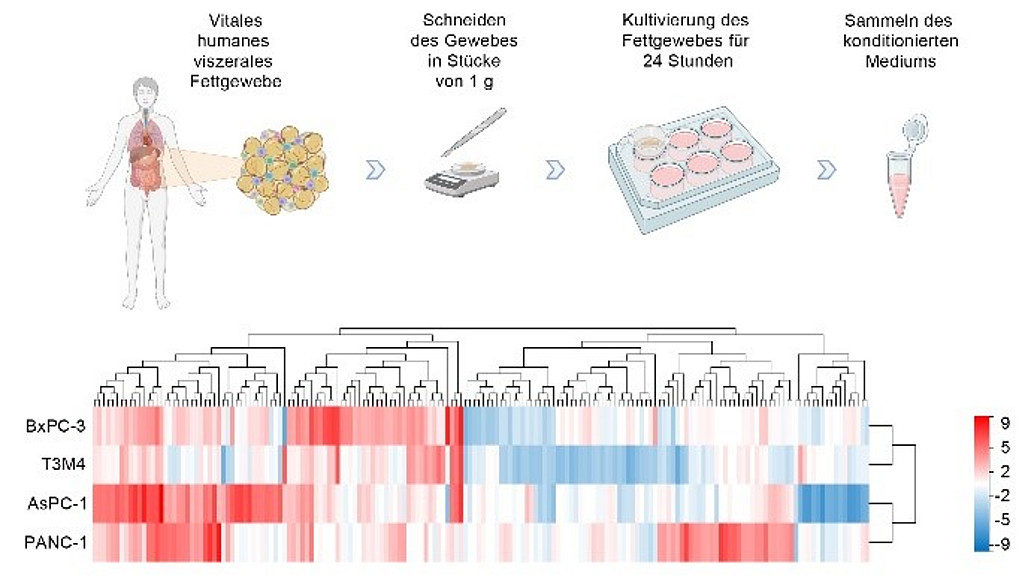
Dazu stellen wir mit humanem Fettgewebe verschiedener Lokalisationen (Überschussmaterial) konditionierte Medien her, die die vom Fettgewebe sezernierten Faktoren enthalten. Mit diesen Medien können wir z.B. PDAC-Zelllinien behandeln. Als exploratives Experiment haben wir zunächst eine RNA-Sequenzierung der Zelllinien nach Behandlung mit konditioniertem Fettmedium durchgeführt und arbeiten derzeit daran, mit Hilfe dieses Datensatzes die parakrinen Effekte des Fettgewebes genauer zu analysieren.
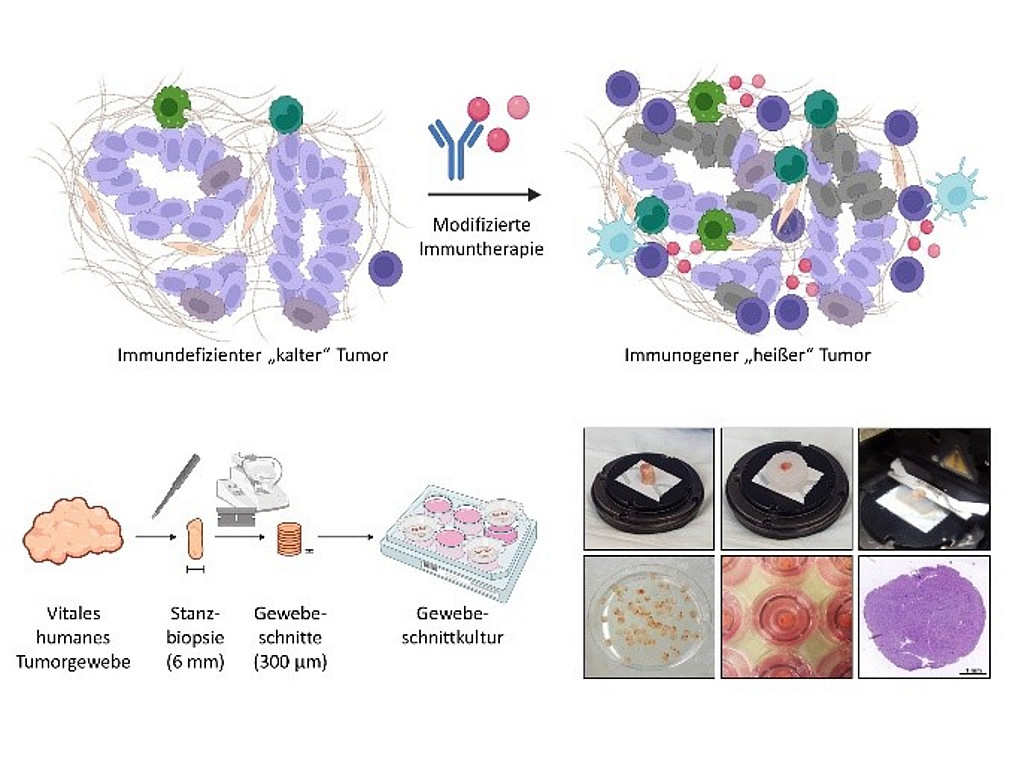
Das duktale Adenokarzinom des Pankreas (PDAC) ist die tödlichste aller Krebserkrankungen des oberen Gastrointestinaltrakts. Das Ansprechen auf Radio- und Chemotherapie sowie auf Immun-Checkpoint-Inhibition (ICI) ist bei PDAC-Patienten oft begrenzt, da die Tumoren in der Regel als wenig immunogene "kalte" Tumoren eingestuft werden. In früheren Mausstudien konnte nachgewiesen werden, dass eine Kombinationstherapie aus Tumor-targetierenden monoklonalen Antikörpern und immunstimulatorischen Zytokinen MHC-Klasse-I-defiziente und dadurch immuntherapieresistente Tumoren für eine ICI-Therapie sensibilisieren kann.
Unser Ziel ist es, die Mechanismen der PDAC-Resistenz besser zu verstehen und das Potenzial der oben genannten Therapie zur Überwindung der Therapieresistenz beim PDAC zu untersuchen.
Zu diesem Zweck haben wir eine Methode etabliert, die es uns erlaubt, Schnitte von menschlichem Tumorgewebe zu kultivieren. Während der Kultivierung bleibt das Tumor- und Immunmilieu größtenteils intakt und ermöglicht so Studien unter physiologischen Bedingungen. Mittels Histologie, Durchflusszytometrie, RT-qPCR etc. können wir dann den Aktivierungszustand der im Gewebe enthaltenen Immunzellen nach der Behandlung verfolgen und eine Aussage über die Wirksamkeit der Behandlung treffen.
Das PDAC ist durch eine ausgeprägte desmoplastische Stromareaktion gekennzeichnet, die zu einer vermehrten Bildung von extrazellulärer Matrix (ECM) führt. Die stromale Komponente nimmt dabei den größten Teil der Tumormasse ein. Die Zusammensetzung und Aktivität des Stromas hat einen entscheidenden Einfluss auf die Tumorprogression. Eine wichtige Rolle spielen dabei ECM abbauende Proteasen, die sowohl die Zusammensetzung des Stromas verändern als auch für die Invasion neoplastischer Zellen in umliegendes Gewebe und die Metastasierung essentiell sind. Eine in diesem Zusammenhang relevante Proteinfamilie sind die ADAMTS-Proteasen, die aus 19 sezernierten Enzymen bestehen.
Unser Ziel ist es, die Rolle der ADAMTS-Proteasen bei der Tumorentstehung, -progression und -metastasierung genauer zu untersuchen.
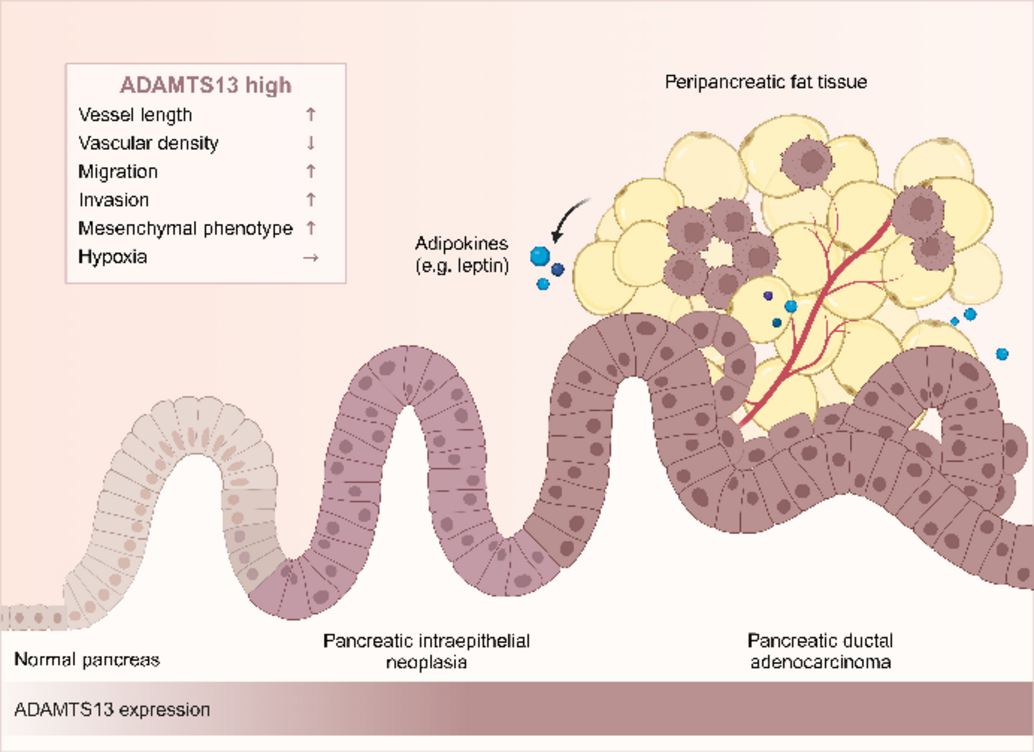
Unter anderem haben wir CRISPR/Cas-vermittelte Knockout-Zelllinien generiert, die mit dem Chorioallantoismembran (CAM)-Xenograft-Modellsystem untersucht wurden, das eine minimal-invasive Erforschung der Krebsbiologie ermöglicht. So konnten wir bereits zeigen, dass ADAMTS13, die von-Willebrand-Faktor spaltende Protease, die vaskuläre Plastizität des PDAC beeinflusst und sowohl die Migration als auch die Invasion von Tumorzellen fördert. Aber auch andere Mitglieder der ADAMTS-Proteasen wurden mit der Progression verschiedener Tumoren in Verbindung gebracht, wobei ihnen duale, d.h. sowohl tumorfördernde als auch tumorhemmende Effekte zugeschrieben werden.
Zellen des Pankreaskarzinoms zeigen sowohl morphologisch als auch in Bezug auf besondere biologische Eigenschaften, wie etwa Chemotherapieresistenz, Migrationsaktivität und Metastasierungsfähigkeit, eine große Plastizität. Ein Erklärungsansatz für die zelluläre Plastizität innerhalb eines Tumors ist die durch spezifische Signalwege kontrollierte Induktion von Transkriptionsfaktoren. PDAC-Zellen exprimieren einen Transkriptionsfaktor, der ursprünglich in Immunzellen beschrieben wurde und dort eine Vielzahl von Funktionen, unter anderem die Resistenz gegen induzierten Zelltod (Apoptose), kontrolliert.
Das Projekt verfolgt zwei Ziele: Einerseits soll die durch den Transkriptionsfaktor kontrollierte Genexpression entschlüsselt werden und andererseits werden Modulatoren identifiziert, die die Aktivität des Transkriptionsfaktors regulieren. Dies soll dazu dienen, mögliche Zielstrukturen im PDAC für eine gerichtete Therapie zugänglich zu machen.
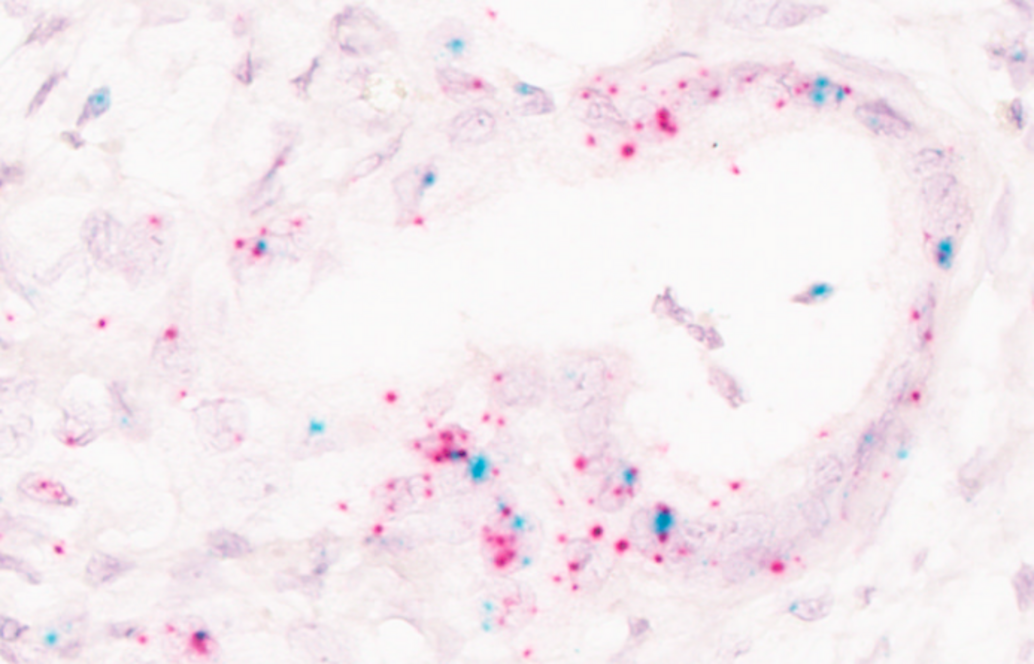
Mittels einer spezifischen RNA-in situ-Hybridisierungsmethode, der RNAScope, wurde der Nachweis erbracht, welche Zellen im humanen PDAC welche Isoform und in welchem Ausmaß exprimieren (siehe Abbildung). Die Identifizierung von isoformspezifischen Downstream-Zielen erfolgt mittels spezifischem Knockout und der Überexpression unterschiedlicher Isoformen des Transkriptionsfaktors in PDAC-Zellen, woraufhin eine RNA-Sequenzierung erfolgt. Im Rahmen der vorliegenden Untersuchung werden neben den Methoden der klassischen Molekularbiologie insbesondere die Charakterisierung von primären Patientenproben mittels klassischer Immunhistochemie sowie fluoreszenzbasierter DNA- und RNA-in-situ-Hybridisierung vorgenommen.
Publikationen:
https://pubmed.ncbi.nlm.nih.gov/?term=Gaida+Matthias&sort=date