Strukturproteine in der Pathogenese chronischer Lebererkankungen
Arbeitsgruppenleitung:
Univ.-Prof. Dr. med. Beate K. Straub
Tel. 06131 17-7307
beate.straub@unimedizin-mainz.de
Arbeitsgruppenmitglieder:
Dr. rer. nat. Romy Mittenzwei
Bettina Jäger
cand. med. Rebecca Hofmann
cand. med. Alexander Untch
Affiliierte Arbeitsgruppe Digitale Pathologie und Künstliche Intelligenz (Krebshilfe-Projekt DECADE):
PD Dr. med. Sebastian Försch
Christina Glasner
Affiliierte Arbeitsgruppe Molekularpathologie:
Dr. med. Michael Kloth
Alumni (Mainz):
PD Dr. med. Dirk A. Ridder
Dr. med. Tiemo S. Gerber
Dr. phil. nat. Hagen R. Witzel
Dr. med. Diane S. Duret
Dr. med. Lana Urbansky
Dr. med. David Sauerbeck
Dr. med. Kristina Lenk, geb. Berndt
Dr. med. Inga Schwittai
Dr. med. Selina Schelbert
Yasmin Krausmüller
Franziska Fischer
Dilan Yesilyurt-Gerhards
Alumni (Heidelberg):
Dr. rer. nat. Lena Pawella
M.D. Ph.D. Merita Hashani
M.D. Ph.D. Benedek Gyöngyösi
Dr. med. Pamela Stöffel
Dr. med. Oscar Cahyadi
Projekt: Lipidtropfen-assoziierte Proteine bei Steatose und Steatohepatitis sowie in der Hepatokarzinogenese
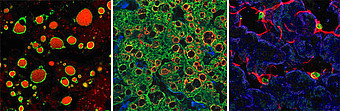
Die Leberparenchymverfettung (Steatosis hepatis) zählt zu den häufigsten chronischen Lebererkrankungen in den westlichen Industrieländern und ist durch verschiedene Umstände ausgelöst, wie z.B. durch Alkoholkonsum, metabolisches Syndrom, Medikamente und Toxine sowie durch eine chronische Hepatitis C. Eine blande Steatose kann zu Steatohepatitis und Leberzirrhose fortschreiten, und die Entstehung Hepatozellulärer Karzinome (HCCs) begünstigen. Lipidtropfen sind dynamische Zellorganellen, deren Biogenese, Strukturerhalt und Abbau von amphiphilen Proteinen der Perilipin-Familie reguliert wird. Aus Tier- und Zelkulturmodellen ist bekannt, dass Perilipine Lipidtropfen stabilisieren und deren Lipolyse kontrollieren. Das Fehlen eines oder mehrerer Perilipine führt zelltypspezifisch zu einer deutlichen Reduktion von Lipidtropfen.
Unsere Arbeitsgruppe konnte zeigen, dass Perilipine bei der Steatogenese im Menschen differentiell an unterschiedlich großen Lipidtropfen, in verschiedenen Zelltypen (Hepatozyten, hepatische Sternzellen), in verschiedenen Leberzonen (periportal versus perizentral), bei unterschiedlichem Steatosegrad und gemäß zeitlicher Entwicklung alle Perilipine vorkommen, und bei chronischer Steatose in Hepatozyten de novo Perilipin 1 gebildet wird. Perilipine sind essentiell für Reifung und Abbau verschiedener Lipidtropfen-Subpopulationen und greifen regulatorisch in die Lipolyse ein, so bindet Perilipin 5 an ATGL und PNPLA3 sowie Perilipin 1 an HSL. Der PNPLA3-Polymorphismus 148M ist mit verstärkter Steatogenese, Inflammation und Fibrose nicht nur steatotischer Lebererkrankungen assoziiiert. In ballonierten Hepatozyten bei Steatohepatitis sind Perilipine sowie Lipasen dereguliert.
Neben der Erforschung der Mechanismen der Steatohepatitis ist ein weiterer Schwerpunkt der Forschung die Untersuchung des Tumormetabolismus. Eine Akkumulation kleiner Lipidtropfen und eine Überexpression von Perilipin 2 sowie 3 sind häufiges Phänomen vieler menschlicher Malignome, insbesondere dem HCC, was als Hinweis für einen veränderten Tumorstoffwechsel interpretiert werden kann (lipogener Phänotyp/ Warburg-Effekt). Eine Herunterregulation von Perilipin 2 und / oder Perilipin 3 in Zellkulturlinien oder in der Maus verringert nicht nur die Triacylglyceridspeicherung in Lipidtropfen, sondern führt auch konsekutiv zu einer Hochregulation anderer Perilipine wie Perilipin 5 und Perilipin 1. Aktuell werden die zugrundeliegenden molekularen Mechanismen und funktionellen Aspekte bei Steatose, Steatohepatitis und in der Hepatokarzinogenese weiter in situ, in vitro und in vivo in Mausmodellen untersucht.
Literatur (Auszug):
- Witzel HR, Schwittai IMG, Hartmann N, Mueller S, Schattenberg JM, Gong XM, Backs J, Schirmacher P, Schuppan D, Roth W, Straub BK*. (2022) PNPLA3(I148M) Inhibits Lipolysis by Perilipin-5-Dependent Competition with ATGL. Cells.12(1):73.
- Straub BK*, Witzel HR, Pawella LM, Renner M, Eiteneuer E, Hashani M, Schirmacher P, Roth W, Mechtersheimer G. (2019) Perilipin 1 Expression Differentiates Liposarcoma from Other Types of Soft Tissue Sarcoma. Am J Pathol. 189(8):1547-1558.
- Hashani M, Witzel HR, Pawella LM, Lehmann-Koch J, Schumacher J, Mechtersheimer G, Schnölzer M, Schirmacher P, Roth W, Straub BK* (2018) Widespread expression of perilipin 5 in normal human tissues and in diseases is restricted to distinct lipid droplet subpopulations. Cell Tissue Res. 374 (1): 121-136
- Kondylis V, Polykratis A, Ehlken H, Ochoa-Callejero L, Straub BK, Krishna-Subramanian S, Van TM, Curth HM, Heise N, Weih F, Klein U, Schirmacher P, Kelliher M, Pasparakis M. (2015) NEMO Prevents Steatohepatitis and Hepatocellular Carcinoma by Inhibiting RIPK1 Kinase Activity-Mediated Hepatocyte Apoptosis. Cancer Cell. 28(5):582-98.
- Pawella LM, Hashani M, Eiteneuer E, Renner M, Bartenschlager R, Schirmacher P, Straub BK*. (2014) Perilipin discerns chronic from acute hepatocellular steatosis. J Hepatol. 60(3):633-42.
- Gruber S, Straub BK, Ackermann PJ, Wunderlich CM, Mauer J, Seeger JM, Büning H, Heukamp L, Kashkar H, Schirmacher P, Brüning JC, Wunderlich FT. (2013) Obesity promotes liver carcinogenesis via Mcl-1 stabilization independent of IL-6Rα signaling. Cell Rep. 4(4):669-80.
- Straub BK*, Gyoengyoesi B, Koenig M, Hashani M, Pawella LM, Herpel E, Mueller W, Macher-Goeppinger S, Heid H, Schirmacher P. (2013) Adipophilin/perilipin-2 as a lipid droplet-specific marker for metabolically active cells and diseases associated with metabolic dysregulation. Histopathology. 62(4):617-31.
- Straub BK*, Herpel E, Singer S, Zimbelmann R, Breuhahn K, Macher-Goeppinger S, Warth A, Lehmann-Koch J, Longerich T, Heid H, Schirmacher P. (2010) Lipid droplet-associated PAT-proteins show frequent and differential expression in neoplastic steatogenesis. Mod Pathol. 23 (3):480-92.
- Straub BK*, Stoeffel P, Heid H, Zimbelmann R and Schirmacher P. (2008) Differential pattern of lipid droplet-associated proteins and de novo perilipin expression in hepatocyte steatogenesis. Hepatology. 47 (6): 1936-1946.
Projekt: Zell-Zell-Kontakte in der Organogenese und Hepatokarzinogenese
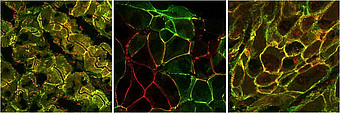
Zell-Zell-Kontakte sind für multizelluläre Organismen eine Grundvoraussetzung und spielen u.a. bei der Embryo- und Organogenese eine essentielle Rolle. Veränderungen der Zell-Zell-Verbindungen vom Typ der sogenannten „Adherens Junctions“ (AJ) sind daneben maßgeblich bei der Entstehung, Progression und Metastasierung von Karzinomen beteiligt. Die Transmembran-Glykoproteine der AJ, klassische Cadherine, werden zell- bzw. gewebs- und differenzierungsspezifisch synthetisiert, zum Beispiel wird E-Cadherin typischerweise von epithelialen Zellen gebildet, N-Cadherin in neuronalen und mesenchymalen Zellen. Der Verlust der membranären E-Cadherin-Expression und die Überexpression von N-Cadherin wurde bei verschiedenen Karzinomen, so auch dem hepatozellulären Karzinom, mit Invasion und Metastasierung korreliert und als „epithelial-mesenchymale Transition“ (EMT) der Tumorzellen gedeutet, die für den Patienten mit einer schlechten Prognose einhergeht. Die Arbeitsgruppe konnte zeigen, dass Hepatozyten und hepatozytäre Zellkulturzellen neben E- auch N-Cadherin bilden und diese in AJ in Form von Heterodimeren vorliegen. E- und N-Cadherin bleiben auch während der Hepato- und Cholangiokarzinogenese relativ stabil exprimiert, so dass sie als Marker für primäre Lebertumoren Anwendung finden können. Das Zelltyp-spezifische Vorkommen von E- und N-Cadherin widerspricht zum einen der Vorstellung, dass epitheliale Zellen kein N-Cadherin tragen, zum anderen stellt es das gängige Dogma in Frage, dass E- und N-Cadherin eine grundsätzlich gegenläufige Verteilung in unterschiedlichen Geweben aufweisen und gegensätzliche Funktionen erfüllen. Die AJ von Hepatozyten, hepatozellulären Karzinomen und davon abgeleiteten Kulturzellen werden deswegen mit proteinbiochemischen, molekularbiologischen, fluoreszenz- und elektronenmikroskopischen Methoden analysiert und ihre Bedeutung für die Organo- sowie Tumorigenese weiter aufgeklärt. Hiermit können nicht nur Rückschlüsse auf die Hepatogenese und Hepatokarzinogenese gezogen werden, sondern auch auf die normale Entwicklung und die Bildung und Progression von Tumoren im Allgemeinen.
Literatur (Auszug):
- Gerber TS, Ridder DA, Goeppert B, Brobeil A, Stenzel P, Zimmer S, Jäkel J, Metzig MO, Schwab R, Martin SZ, Kiss A, Bergmann F, Schirmacher P, Galle PR, Lang H, Roth W, Straub BK* (2024) N-cadherin: A diagnostic marker to help discriminate primary liver carcinomas from extrahepatic carcinomas. Int J Cancer. 154(10):1857-1868.
- Gerber TS, Ridder DA, Schindeldecker M, Weinmann A, Duret D, Breuhahn K, Galle PR, Schirmacher P, Roth W, Lang H, Straub BK* (2022) Constitutive Occurrence of E:N-cadherin Heterodimers in Adherens Junctions of Hepatocytes and Derived Tumors. Cells. 11(16):2507.
- Gerber TS, Goeppert B, Hausen A, Witzel HR, Bartsch F, Schindeldecker M, Gröger L-K, Ridder DA, Cahyadi O, Esposito E, Gaida MM, Schirmacher P, Galle PR, Lang H, Roth W, Straub BK* (2022) N-Cadherin Distinguishes Intrahepatic Cholangiocarcinoma from Liver Metastases of Ductal Adenocarcinoma of the Pancreas. Cancers: 14(13):3091.
- Gerber TS, Bartsch F, Wagner DC, Schindeldecker M, Heuft LK, Roth W, Lang H, Straub BK*. (2021) Clinicopathological Significance of Syndecan-1 in Cholangiocarcinoma: A Study Based on Immunohistochemistry and Public Sequencing Data. J Clin Med. 10(13):2745.
- Has C, Spartà G, Kiritsi D, Weibel L, Moeller A, Vega-Warner V, Waters A, He Y, Anikster Y, Esser P, Straub BK, Hausser I, Bockenhauer D, Dekel B, Hildebrandt F, Bruckner-Tuderman L, Laube GF. (2012) Integrin a3 mutations with kidney, lung, and skin disease. N Engl J Med. 366(16):1508-14.
- Géraud C, Evdokimov K, Straub BK, Peitsch WK, Demory A, Dörflinger Y, Schledzewski K, Schmieder A, Schemmer P, Augustin HG, Schirmacher P, Goerdt S. (2012) Unique cell type-specific junctional complexes in vascular endothelium of human and rat liver sinusoids. PLoS One. 7(4):e34206.
- Straub BK, Rickelt S, Zimbelmann R, Grund C, Kuhn C, Iken M, Ott M, Schirmacher P, Franke WW. (2011) E-N-cadherin heterodimers define novel adherens junctions connecting endoderm-derived cells. J Cell Biol. 195(5):873-87.
- Straub BK, Schnölzer M, Korf U, Kempf T, Spring H, Kuhn C and Franke WW (2003). A novel type of junction system: The cortex adhaerens mosaic of lens fiber cells. J Cell Sci 116: 4985-4995.
Drittmittel:
- 2023-2026: Krebshilfe (Verbundprojekt DECADE zu KI im kolorektalen Karzinom)
- 2019-2025: Else-Kröner-Fresenius-Stiftung (Clinician Scientist Programm zum Themenschwerpunkt Lebertumoren, Ko-Sprecherin)
- 2015-2022: EU Horizon (LITMUS, Mitarbeit als Expert Histopathologist)
- 2010-2018: DFG (Einzelanträge DFG STR 1160/1-1 und 1-2 zu Lipidtropfen-assoziierten Proteinen bei Steatose, Steatohepatitis und Hepatokarzinogenese), assoziiert an SFB / TR HCC
- 2006-2007 sowie 2013-2014:DAAD-projektbezogener Personenaustausch mit Ungarn (Heidelberg – Budapest)
- 2006-2007: Landesstiftung Baden-Württemberg: Verbundprojekt Hepatokarzinogenese
Jobs:
Medizinstudierende, die an einer experimentellen medizinischen Dissertation Interesse haben, sind herzlich willkommen.