Strahlenbiologische Forschung
Leitung: PD Dr. rer. nat. et med. habil. Sebastian Zahnreich

PD Dr. rer. nat. et med. habil. Sebastian Zahnreich
Wissenschaftliche Schwerpunkte und Projekte:
Strahlenbiologie und Radioonkologie
Biologische Dosimetrie
Biologische Wirkung unterschiedlicher Strahlenqualitäten und komplexer Mischfelder
Individuelle Strahlenempfindlichkeit und DNA Reparaturdefizienz(syndrome)
Spätfolgen der Radiotherapie, insbesondere sekundäre primäre Malignome
Radiotherapie im Kontext multimodaler Strategien bei Kopf-Hals Tumoren
Radioimmunoonkologie
Diplom-Biologe
Die strahlenbiologische Forschung des radioonkologischen Forschungslabors widmet sich der Untersuchung biologischer und physikalischer Grundlagen der Wirkung ionisierender Strahlung auf zelluläre Systeme im Kontext radiotherapeutischer Anwendungen sowie dem Strahlenschutz.
Intrinsische Strahlenempfindlichkeit: Identifikation biologischer und epidemiologischer Langzeitfolgen
https://www.unimedizin-mainz.de/isibela/startseite/willkommen.html
Ein Hauptaugenmerk der wissenschaftlichen Arbeit richtet sich auf die Untersuchung von zellulären Prozessen, die mit unerwünschten Spätfolgen der Strahlentherapie und insbesondere der Entwicklung vom Primärtumor unabhängigen sekundären Tumoren in Verbindung gebracht werden. Unser Ziel ist es in einem interdisziplinären Forscherverbund zu klären, ob ehemalige Patienten mit Krebserkrankungen im frühen Kindesalter und einer hohen Anfälligkeit für die Entwicklung von weiteren und wahrscheinlich therapieassoziierten Sekundärmalignomen ein eingeschränktes Reparaturvermögen für endogene oder durch die Krebstherapie induzierte DNA Schäden aufweisen. Daher wird in normalen somatischen Bindegewebszellen dieser Spender, die über das Deutsche Kinderkrebsregister in Mainz rekrutiert wurden, die intrinsische Stabilität des Genoms sowie die zelluläre und chromosomale Sensitivität gegenüber einer DNA-schädigenden Exposition mit ionisierender Strahlung oder induziertem Replikationsstress mit folgenden Methoden analysiert:
Intrinsische Strahlenempfindlichkeit: Identifikation biologischer und epidemiologischer Langzeitfolgen
https://www.unimedizin-mainz.de/isibela/startseite/willkommen.html
Ein Hauptaugenmerk der wissenschaftlichen Arbeit richtet sich auf die Untersuchung von zellulären Prozessen, die mit unerwünschten Spätfolgen der Strahlentherapie und insbesondere der Entwicklung vom Primärtumor unabhängigen sekundären Tumoren in Verbindung gebracht werden. Unser Ziel ist es in einem interdisziplinären Forscherverbund zu klären, ob ehemalige Patienten mit Krebserkrankungen im frühen Kindesalter und einer hohen Anfälligkeit für die Entwicklung von weiteren und wahrscheinlich therapieassoziierten Sekundärmalignomen ein eingeschränktes Reparaturvermögen für endogene oder durch die Krebstherapie induzierte DNA Schäden aufweisen. Daher wird in normalen somatischen Bindegewebszellen dieser Spender, die über das Deutsche Kinderkrebsregister in Mainz rekrutiert wurden, die intrinsische Stabilität des Genoms sowie die zelluläre und chromosomale Sensitivität gegenüber einer DNA-schädigenden Exposition mit ionisierender Strahlung oder induziertem Replikationsstress mit folgenden Methoden analysiert:
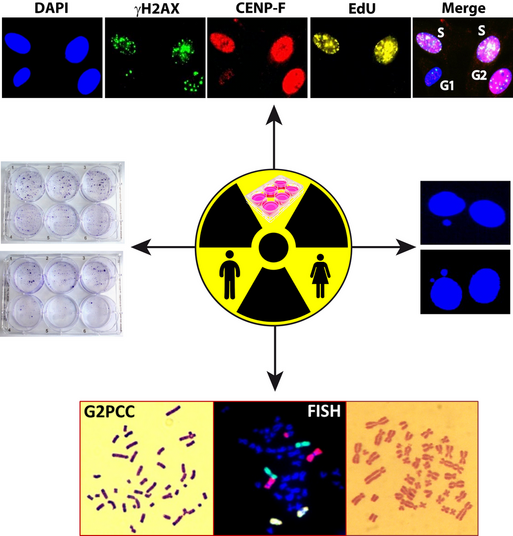
- Zellzyklusspezifische Quantifizierung sogenannter Foci verschiedener DNA Reparaturproteine
- Chromosomale Aberrationen in 1. Mitosen sowie frühzeitige Chromosomenkondensation in der G2 Phase des Zellzyklus (G2 premature chromosome condensation, G2PCC) nach Bestrahlung
- Fluoreszenz in situ Hybridisierungen
- Cytokinesis-block micronucleus (CBMN) cytome Assay
- Klonogenes Zellüberleben
Biologische Dosimetrie
Jede zufällige oder geplante Exposition gegenüber ionisierender Strahlung birgt ein relatives Risiko für die Entwicklung von kurz- oder langfristigen gesundheitlichen Beeinträchtigungen. Durch die zunehmende Nutzung von radioaktiven Quellen und Röntgenstrahlen in der diagnostischen und therapeutischen Radiologie, der industriellen und landwirtschaftlichen Forschung sowie für militärische Zwecke steigt stetig das Risiko einer erhöhten Strahlenbelastung in der gesamten Bevölkerung. Im Falle einer Überexposition ist daher eine genaue und zeitnahe Bestimmung der absorbierten Strahlendosis sowie des Expositionsszenarios für die Abschätzung klinischer Folgen und das Einleiten medizinischer Gegenmaßnahmen essentiell. Ist jedoch keine exakte physikalische Messung der absorbierten Strahlendosis möglich, wie z.B. bei den meisten Strahlenunfällen, wird hierfür die biologische Dosimetrie herangezogen. Diese basiert auf der retrospektiven Quantifizierung strahleninduzierter Modifikationen geeigneter biologischer Moleküle, die meist minimal-invasiv in peripheren Lymphozyten durchgeführt wird. Anschließende Dispersionsanalysen ermöglichen eine Diskriminierung zwischen Teil- und Ganzkörperexpositionen und ein quantitativer Abgleich mit Referenzdaten erlaubt die Abschätzung der absorbierten Teil- und Ganzkörperdosis. Der momentane Goldstandard der biologischen Dosimetrie ist die retrospektive Quantifizierung dizentrischer Chromosomen in Lymphozyten. Eine niedrige Sensitivität und ein hoher Zeitaufwand von mehreren Tagen limitieren jedoch den Einsatz dieser Methode in der Radiologie und bei Strahlenunfällen großen Ausmaßes. Eine wesentlich schnellere und sensitivere Methode stellt ein neuer biodosimetrischer Ansatz der Immunfluoreszenzbasierten Quantifizierung der phosphorylierten Histonvariante H2AX (g-H2AX), einem anerkannten Indikator für DNA-Doppelstrangbrüche, dar. Diese erlaubt die Abschätzung sehr niedriger Strahlendosen im Bereich weniger mGy binnen weniger Stunden. Beide Methoden werden in unseren Laboren standardisiert in biodosimetrischen Studien für die Ermittlung der Strahlenbelastung durch eine Strahlentherapie mit unterschiedlichen Bestrahlungstechniken bei Patienten mit verschiedenen Tumorentitäten angewendet.
Jede zufällige oder geplante Exposition gegenüber ionisierender Strahlung birgt ein relatives Risiko für die Entwicklung von kurz- oder langfristigen gesundheitlichen Beeinträchtigungen. Durch die zunehmende Nutzung von radioaktiven Quellen und Röntgenstrahlen in der diagnostischen und therapeutischen Radiologie, der industriellen und landwirtschaftlichen Forschung sowie für militärische Zwecke steigt stetig das Risiko einer erhöhten Strahlenbelastung in der gesamten Bevölkerung. Im Falle einer Überexposition ist daher eine genaue und zeitnahe Bestimmung der absorbierten Strahlendosis sowie des Expositionsszenarios für die Abschätzung klinischer Folgen und das Einleiten medizinischer Gegenmaßnahmen essentiell. Ist jedoch keine exakte physikalische Messung der absorbierten Strahlendosis möglich, wie z.B. bei den meisten Strahlenunfällen, wird hierfür die biologische Dosimetrie herangezogen. Diese basiert auf der retrospektiven Quantifizierung strahleninduzierter Modifikationen geeigneter biologischer Moleküle, die meist minimal-invasiv in peripheren Lymphozyten durchgeführt wird. Anschließende Dispersionsanalysen ermöglichen eine Diskriminierung zwischen Teil- und Ganzkörperexpositionen und ein quantitativer Abgleich mit Referenzdaten erlaubt die Abschätzung der absorbierten Teil- und Ganzkörperdosis. Der momentane Goldstandard der biologischen Dosimetrie ist die retrospektive Quantifizierung dizentrischer Chromosomen in Lymphozyten. Eine niedrige Sensitivität und ein hoher Zeitaufwand von mehreren Tagen limitieren jedoch den Einsatz dieser Methode in der Radiologie und bei Strahlenunfällen großen Ausmaßes. Eine wesentlich schnellere und sensitivere Methode stellt ein neuer biodosimetrischer Ansatz der Immunfluoreszenzbasierten Quantifizierung der phosphorylierten Histonvariante H2AX (g-H2AX), einem anerkannten Indikator für DNA-Doppelstrangbrüche, dar. Diese erlaubt die Abschätzung sehr niedriger Strahlendosen im Bereich weniger mGy binnen weniger Stunden. Beide Methoden werden in unseren Laboren standardisiert in biodosimetrischen Studien für die Ermittlung der Strahlenbelastung durch eine Strahlentherapie mit unterschiedlichen Bestrahlungstechniken bei Patienten mit verschiedenen Tumorentitäten angewendet.