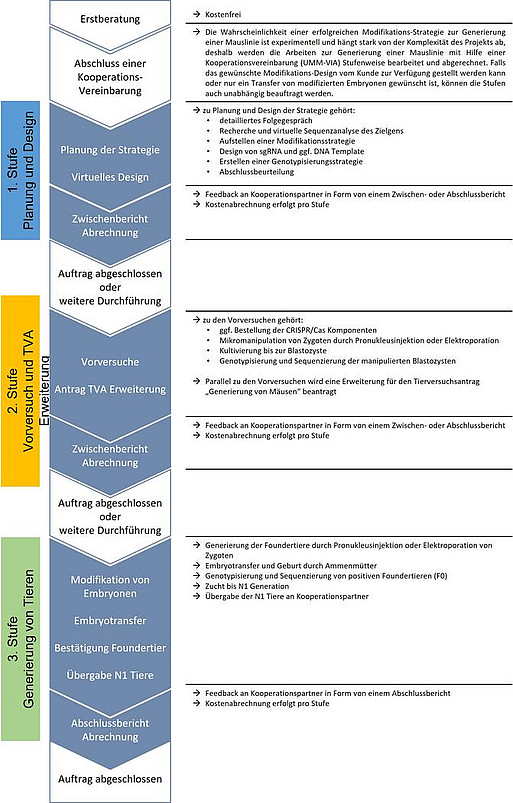
Generierung einer Mauslinie
Trotz intensiver Forschung bezüglich Alternativmethoden, ist der Tierversuch in der biomedizinischen Forschung derzeit vielfach ein nicht ersetzbares Mittel für den Erkenntnisgewinn. Eine zentrale Rolle spielen hierbei gentechnisch veränderte Mäuse (GVM). Sie liefern einen wichtigen Beitrag für die Erforschung von Genfunktionen und werden weiter als Modelle humaner Krankheiten herangezogen. Häufig ist die Untersuchung eines Gens oder eines Gendefekts nur im Kontext des gesamten Organismus vollständig möglich, da nur so Wechselwirkungen auf zellulärer Ebene, auf Organebene oder sogar zwischen Individuen mit einbezogen werden. Mit einem optimierten Modellorganismus kann die benötigte Versuchstierzahl zur Klärung wissenschaftlicher Fragestellungen der medizinischen Forschung erheblich reduziert werden.Das BioGen Team bietet die Generierung neuer Mauslinien mit Hilfe diverser gentechnischen Methoden an. Der Service beginnt mit einer Beratung und der Planung des Projekts, bei der über die Auswahl der entsprechenden Modifikationsstrategie gesprochen wird und das Design der einzelnen Komponenten festgelegt wird. Darauf folgen Vorversuche, in denen die Erfolgswahrscheinlichkeit der gewünschten Modifikation und die Funktion der einzelnen Komponenten getestet wird. Sobald alle Vorversuche erfolgreich abgeschlossen sind, werden Zygoten durch eine zufällige transgene Integration, einen Knock-Out oder einen Knock-In modifiziert und anschließend über einen Embryotransfer von Ammenmäusen ausgetragen.
Unsere Leistungen sind:
- Generierung einer transgenen Mauslinie
- Generierung einer Knock-Out Mauslinie
- Generierung einer Knock-In Mauslinie

Generierung einer Mauslinie durch Pronukleusinjektion
Generierung einer transgenen Mauslinie
Bei der klassischen Methode „Generierung einer transgenen Mauslinie“ wird das gewünschte Transgen an zufälliger Stelle im Genom der Maus integriert.Für die Generierung einer transgenen Mauslinie wird ein zuvor entwickeltes DNA-Konstrukt mit der gewünschten genetischen Information mittels Pronukleusinjektion in den Zellkern einer Zygote transportiert. Dort wird die gewünschte genetische Information an zufälliger Position innerhalb des Genoms des Mausembryos integriert. Die modifizierten Embryonen werden in Ammenmäuse transferiert und ausgetragen. Anschließend werden die geworfenen Jungtiere mittels Genotypisierung und Sequenzierung auf die korrekte Integration der Sequenz analysiert.
Generierung einer Knock-Out Mauslinie
Bei der Methode „Generierung einer Knock-Out Mauslinie“ wird eine Mauslinie mittels zielgerichtetem Knock-Out eines Gens im Genom der Maus generiert.Für die Generierung einer Knock-Out Mauslinie wird die codierende Sequenz des Zielgens mit Hilfe des CRISPR/Cas Systems modifiziert. Dadurch kann eine Genexpression für ein funktionales Protein verhindert werden. Der Gen Knock-Out kann durch eine Punktmutation, Deletion, Insertion oder dem Austausch der Gensequenz hervorgerufen werden. Die modifizierten Embryonen werden in Ammenmäuse transferiert und ausgetragen. Anschließend werden die geworfenen Jungtiere mittels Genotypisierung und Sequenzierung auf die korrekte Modifikation der Gensequenz analysiert.
Generierung einer Knock-In Mauslinie
Bei der Methode „Generierung einer Knock-In Mauslinie“ wird eine Mauslinie mittels zielgerichtetem Knock-In einer codierenden Sequenz in das Genom der Maus generiert.Für die Generierung einer Knock-In Mauslinie wird ein gewünschtes codierendes DNA-Konstrukt mit Hilfe des CRISPR/Cas Systems zielgerichtet durch „homology directed repair“ (HDR) in das Genom der Maus integriert. Dadurch kann die Expression der gewünschten DNA-Sequenz unter einem bestimmten Promotor im Genom der Maus erreicht werden. Die modifizierten Embryonen werden in Ammenmäuse transferiert und ausgetragen. Anschließend werden die geworfenen Jungtiere mittels Genotypisierung und Sequenzierung auf die korrekte Integration des codierendes DNA-Konstrukts analysiert.
Service Informationen
Zeitliches Ablaufschema der Generierung einer Mauslinie
(Zum Vergrößern auf die Grafik klicken)
Voraussetzungen für das DNA-Konstrukt
Die Qualität der DNA ist entscheidend für den Erfolg der DNA Modifikation. Unzureichend gereinigte DNA erschwert die Injektionen und/oder verringert die Überlebensrate. Spuren von Phenol, Ethanol, Salzen oder Enzymen sind für die Embryonen giftig. Auch die DNA-Konzentration ist ein entscheidender Faktor für den Erfolg der Modifikation. Überschüssige DNA ist toxisch und kann zu einem Entwicklungsstillstand führen. Zu verdünnte DNA verringert die Wahrscheinlichkeit der Modifikation.
Beschränkungen bis Bestätigung des SPF Hygienestatus
Isolation in der SPF Haltung für mindestens 8 Wochen. Freitestung durch Hygiene Monitoring (Serologie + Parasitologie)