Plattform 8
Vaskuläre Wundheilung
Die Ruptur einer atherosklerotischen Plaque mit nachfolgender Thrombose und Minder-durchblutung im nachgeschalteten Perfusionsgebiet ist eine häufige Komplikation im Herz-/Kreislaufsystem und äußert sich klinisch z.B. als Myokardinfarkt, Schlaganfall oder peripher-arterielle Ischämie. Beim Überleben des akuten Ereignisses treten sog. Wundheilungsprozesse in Kraft, die zur Wiederherstellung der vaskulären Integrität und Gewebedurchblutung beitragen, jedoch auch gestört ablaufen können (z. B. beim Vorliegen kardiovaskulärer Risikofaktoren). Zur Untersuchung der Pathophysiologie vaskulärer Reparaturprozesse wurden spezielle Mausmodelle entwickelt, die eine detaillierte Untersuchung der zeitlichen und räumlichen Abläufe sowie kritischer Mediatoren oder therapeutischer Strategien unter standardisierten Bedingungen erlauben.
Modelle und Methoden
Das Plattformlabor „Vaskuläre Wundheilung“ bietet folgende Methoden zur Analyse von Reparaturprozessen nach arterieller Thrombose oder Ischämie an:- Morphometrie der chronischen Neointimabildung (Restenose) nach Eisenchlorid-induzierter Thrombose der A. carotis communis oder atherosklerotischer Läsionen (Aortenwurzel, A. brachiocephalica) im Mausmodell
- Protokolle zur immunhistochemischen Analyse der zellulären und strukturellen Zusammensetzung vaskulärer Läsionen
- Nicht-invasive Quantifizierung der Wiederherstellung der Durchblutung (mittels Laser Doppler Perfusion Imaging) nach Induktion einer unilateralen Hinterlaufischämie im Mausmodell
- Quantifizierung der Gefäßneubildung (Angio- und Arteriogenese) in vivo, ex vivo und in vitro (z.B. Matrigel™- und Sphäroid-Angiogenese-Assay)
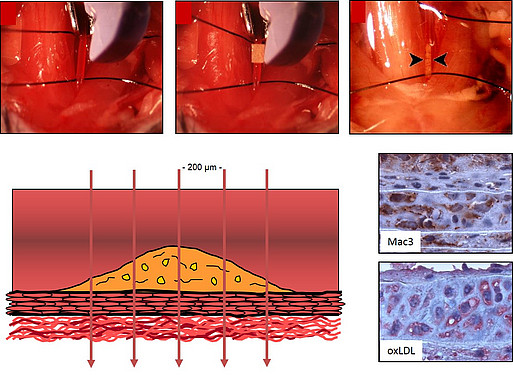
Eisen-III-Chlorid (FeCl3) Mausmodell der arteriellen Thrombose und Neointimabildung
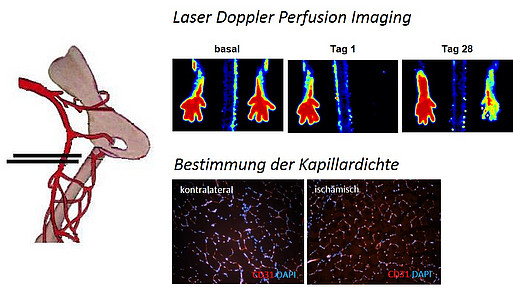
Mausmodell der unilateralen Hinterlaufischämie zur Analyse der Gefäßneubildung
Abgeschlossene Kooperationsprojekte
- Chrysanthopoulou A, Kambas K, Stakos D, Mitroulis I, Mitsios A, Vidali V, Angelidou I, Bochenek M, Arelaki S, Arampatzioglou A, Galani IE, Skendros P, Couladouros EA, Konstantinides S, Andreakos E, Schäfer K, Ritis K. Interferon lambda1/IL-29 and inorganic polyphosphate are novel regulators of neutrophil-driven thromboinflammation. J Pathol. 2017 Sep;243(1):111-122.
- Luther N, Brähler M, Krebs F, Jäckel S, Subramaniam S, Stanger C, Schönfelder T, Reinhardt C, Wenzel P, Schäfer K, Becker C. Innate effector-memory T cell activation regulates post-thrombotic vein wall inflammation and thrombus resolution. Circ Res. 2016;119:1286-1295.
- Karbach S, Schönfelder T, Brandao I, Wilms E, Hörmann N, Jäckel S, Schüler R, Finger S, Knorr M, Lagrange J, Brandt M, Waisman A, Kossmann S, Schäfer K, Münzel T, Reinhardt C, Wenzel P. Gut microbiota promote Angiotensin II-induced arterial hypertension and vascular dysfunction. J Am Heart Assoc. 2016; Aug 30;5(9). pii: e003698.
- Ben-Zvi D, Savion N, Kolodgie F, Simon A, Fisch S, Schäfer K, Bachner-Hinenzon N, Cao X, Gertler A, Solomon G, Kachel E, Raanani E, Lavi Y, Emeth SK, Virmani R, Schoen F, Schneiderman J. Local leptin antagonist attenuates angiotensin II-induced ascending aortic aneurysm. J Am Heart Assoc. 2016; May 3;5(5). pii: e003474.
Wissenschaftlicher Plattform-Koordinator

Univ.-Prof. Dr. med. Katrin Schäfer
Leitung der Arbeitsgruppe „Translationale Vaskuläre Biologie“, Abteilung Kardiologie und Angiologie / Center for Thrombosis and Hemostasis
Plattform-Supervisor

Dr. phil. Magdalena Bochenek
Wissenschaftliche Mitarbeiterin, Arbeitsgruppe „Translationale Vaskuläre Biologie“